题目内容
11.某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性.它是以中学化学中常见物质为原料来生产的,图中C、M、K均含A元素,M的分子式为A(NH2)4;E为不含A 元素的氢化物,在空气中易形成白雾;G、F均为难溶于水的白色沉淀,H为氧化物,J为气体;其余物质均为中学化学中常见物质.(提示:NH3和H2O的化学性质在某些方面相似)
请回答下列问题:
(1)写出指定物质的化学式:ASi,CSiCl4,FH2SiO3.
(2)K的化学式为Si3N4.
(3)写出图中下列序号的化学方程式:
反应④Si+2NaOH+H2O=Na2SiO3+2H2↑;
反应⑤SiO2+2NaOH=Na2SiO3+H2O.
(4)写出图中反应⑥的离子方程式:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
分析 根据题中各物质转化关系,F受热失去水得H,H能与氢氧化钠反应生成I,I与过量的二氧化碳反应生成F,说明F为弱酸且能受热分解,结合化合物M中A可形成四个价键知:A元素为四价元素,C、M、K均含A元素,K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性,所以可推断为Si3N4,G、F均为难溶于水的白色沉淀,H为氧化物,结合转化关系可以确定A为Si,H为SiO2,I为Na2SiO3,则F为H2SiO3,E为不含A 元素的氢化物,在空气中易形成白雾,E与硝酸银反应生成不溶于稀硝酸的沉淀G,则E为HCl,G为AgCl,故C为SiCl4,B为Cl2;A与氢氧化钠反应生成J和I,J为气体,则J为H2,结合推断出的物质进行分析解答问题.
解答 解:根据题中各物质转化关系,F受热失去水得H,H能与氢氧化钠反应生成I,I与过量的二氧化碳反应生成F,说明F为弱酸且能受热分解,结合化合物M中A可形成四个价键知:A元素为四价元素,C、M、K均含A元素,K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性,所以可推断为Si3N4,G、F均为难溶于水的白色沉淀,H为氧化物,结合转化关系可以确定A为Si,H为SiO2,I为Na2SiO3,则F为H2SiO3,E为不含A 元素的氢化物,在空气中易形成白雾,E与硝酸银反应生成不溶于稀硝酸的沉淀G,则E为HCl,G为AgCl,故C为SiCl4,B为Cl2;A与氢氧化钠反应生成J和I,J为气体,则J为H2,
(1)根据上面的分析可知,A为Si,C为SiCl4,F为H2SiO3,故答案为:Si;SiCl4;H2SiO3;
(2)根据上面的分析可知,K的化学式为Si3N4,故答案为:Si3N4;
(3)反应④的化学方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑,反应⑤的化学方程式为SiO2+2NaOH=Na2SiO3+H2O,
故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑;SiO2+2NaOH=Na2SiO3+H2O;
(4)图中反应⑥的离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
点评 本题考查了物质转化关系的性质应用和判断,主要考查硅及其化合物的性质变化,利用题给条件,结合特征反应和特征转化进行分析推断是解题关键.

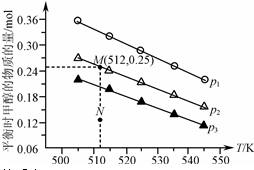 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512K时,图中N点v(正)<v(逆) |

| A. | 由红外光谱可知,该有机物的结构简式为CH3OH | |
| B. | 由核磁共振氢谱可知,该有机物分子中有3个氢原子 | |
| C. | 综合上述两种谱图分析,可以得知其A的相对分子质量 | |
| D. | 若A的化学式为C2H6O,则其结构简式为CH3CH2OH |
| A. | 氢氧化钡溶液与稀硫酸的反应 OH-+H+═H2O | |
| B. | 氧化钙与稀盐酸反应 CaO+2H+═Ca2++H2O | |
| C. | 铁片插入硝酸银溶液中 Fe+Ag+═Fe2++Ag | |
| D. | 碳酸钙溶于稀硝酸中 CO32-+2H+═CO2↑+H2O |
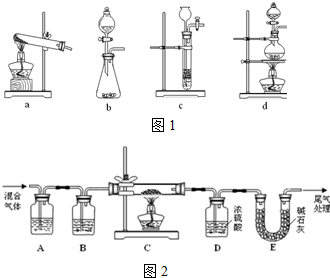
(1)草酸(H2C2O4)浓硫酸并加热条件下分解的化学方程式为:H2C2O4 $\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O下列装置中如图1,可用于草酸分解制取气体的是d.(填字母)
(2)某探究小组利用草酸分解产生的混合气体和铁锈反应来测定铁锈样品组成(假定铁锈中只有Fe2O3•nH2O和Fe两种成份),实验装置如下图2所示,请回答:
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的试剂分别是浓NaOH溶液、浓硫酸.
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性(或先排尽装置内空气,以防止加热时发生爆炸);(b)通入混合气体一段时间.
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量,硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=2(假定Fe和H2O不发生反应,实验过程中每步均完全吸收或反应).
④在本实验中,下列情况会使测定结果n偏大的是abc(填字母).
a.缺少洗气瓶B b.缺少装置E
c.反应后固体是铁和少量Fe2O3 d.反应后固体是铁和少量Fe2O3•nH2O
(3)该探究小组还利用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
①请完成以下实验设计表(表中不要留空格):
每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL,催化剂MnSO4的用量可选择0.5g、0.0g)
②若要准确计算反应速率,该实验中还需测定溶液紫色消失所需要的时间.请你设计出通过测定褪色时间长短来判断浓度大小与反应速率关系的实验方案:
| 实验 编号 | 实验目的 | T/K | 催化剂用量/g | c/mol•l-1 | |
| KMnO4 | H2C2O4 | ||||
| Ⅰ | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| Ⅱ | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| Ⅲ | 323 | 0.5 | 0.01 | 0.1 | |
| Ⅳ | 探究催化剂对反应速率的影响 | 0.1 | |||
③写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式:2MnO4_+5H2C2O4+6H+=10CO2↑+8H2O+2Mn2+.
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去产物只有1种 的消去产物只有1种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
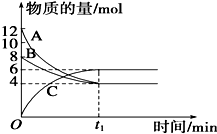 某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析: