题目内容
2.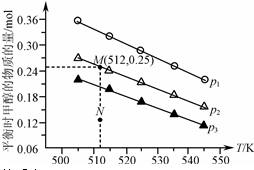 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512K时,图中N点v(正)<v(逆) |
分析 A.根据图象,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动;
B.根据图象,作一条等温线,根据该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大判断;
C.由图可知,M点对应的甲醇产量为0.25mol,据此列三段式结合平衡常数K的计算公式进行计算;
D.由图可知,在p2及512 K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动.
解答 解:A.由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动,则正反应为放热反应,故A正确;
B.由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以p1>p2>p3,故B错误;
C.由图可知,M点对应的甲醇产量为0.25mol,则
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 2.75 0 0
反应 0.25 0.75 0.25 0.25
平衡 0.75 2 0.25 0.25
又体积为1.0L,所以K=$\frac{0.25×0.25}{0.75×{2}^{3}}$=1.04×10-2,故C正确;
D.由图可知,在p2及512 K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动,则v(正)>v(逆),故D错误;
故选BD.
点评 本题考查温度、压强等之间的关系,明确外界条件对平衡的影响,学会采用定一议二法分析图象是解本题的关键,难度中等.

练习册系列答案
相关题目
17.将100ml.0.1mol•L-1BaCl2涪液与100ml.0.2mol•L-1AICl3溶液混合,不考虑溶液混合时体积的变化,混合溶液中氯离子的浓度是( )
| A. | 0.1 mol•L-l | B. | 0.2 mol•L-l | C. | 0.3 mol•L-l | D. | 0.4 mol•L-l |
14.同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )
| A. | 体积比 1:1 | B. | 体积比 11:16 | ||
| C. | 物质的量比 16:11 | D. | 密度比 11:16 |
12.下列有关强、弱电解质的叙述正确的是( )
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题: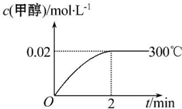 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为CO(g)+2H2(g)═CH3OH(g)△H<0.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为CO(g)+2H2(g)═CH3OH(g)△H<0.