题目内容
3.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0,已知该反应在2404℃时,平衡常数K=64×10-4.请回答:(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则NO表示的反应速率0.1mol/(L•min).
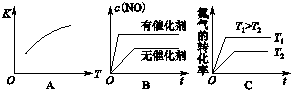
(2)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是AC(填字母序号).
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态.与原平衡状态相比,此时平衡混合气中NO的体积分数不变.(填“变大”、“变小”或“不变”)
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应向正反应方向进行 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是$\frac{(3×1{0}^{-3})^{2}}{(2.5×1{0}^{-1})(4×1{0}^{-2})}$=9×10-4<K=64×10-4.
分析 (1)5分钟内,△n(O2)=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(NO)=1mol,代入v=$\frac{△n}{V•△t}$计算;
(2)根据温度、催化剂对反应速率和平衡移动的影响判断;
(3)根据化学方程式的特点结合压强对平衡的影响分析;
(4)计算某时刻生成物的浓度幂之积与反应物浓度幂之积的比值,与该温度下的平衡常数相比较,可得出结论;
解答 解:(1)5分钟内,△n(O2)=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(NO)=1mol,v(N2)=$\frac{△n}{V•△t}$=$\frac{1mol}{2L×5min}$=0.1mol/(L•min),
故答案为:0.1mol/(L•min);
(2)A、该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;
B、加入催化剂,反应速率增大,但平衡不发生移动,故B错误;
C、升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确;
故答案为:AC;
(3)该反应中,气体的化学计量数之和前后相等,压强对平衡移动没有影响,只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时平衡混合气中NO的体积分数;
故答案为:不变;
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为:$\frac{(3×1{0}^{-3})^{2}}{(2.5×1{0}^{-1})(4×1{0}^{-2})}$=9×10-4<K=64×10-4,则反应应向正反应方向进行;
故答案为:向正反应方向进行; $\frac{(3×1{0}^{-3})^{2}}{(2.5×1{0}^{-1})(4×1{0}^{-2})}$=9×10-4<K=64×10-4;
点评 本题考查化学反应速率、化学平衡移动原理、化学平衡的有关计算,题目难度中等,注意平衡常数的计算和应用.

| A. | 体积比 1:1 | B. | 体积比 11:16 | ||
| C. | 物质的量比 16:11 | D. | 密度比 11:16 |
| A. | 摩尔质量就等于该物质的相对分子质量或相对原子质量 | |
| B. | 硫酸的摩尔质量是98克 | |
| C. | 1molH2O的质量为18克 | |
| D. | 2molH2O的质量为18克 |
| A. | 天然气燃烧 | B. | 浓硫酸溶于水 | ||
| C. | CaO与水反应 | D. | B a(OH)2晶体与NH4Cl反应 |
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
| A. | 在1L 0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA | |
| B. | 常温常压下,Na202与足量H20反应,生成4.48L 02,转移电子的数目为0.2NA | |
| C. | 在密闭容器中充人1.5 mol H2和0.5 mol N2,充分反应后可得到NH3的分子数为NA | |
| D. | 电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32g |
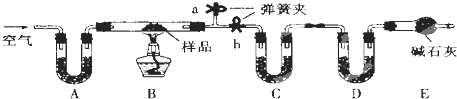

 .
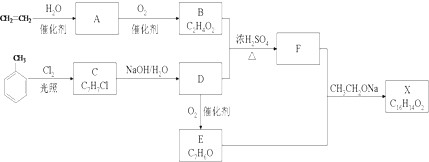
.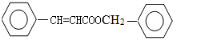 .
.