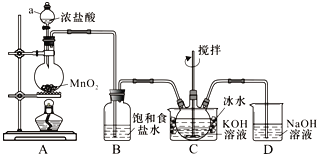
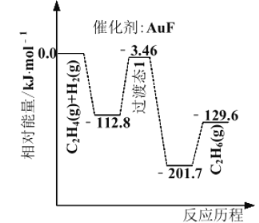
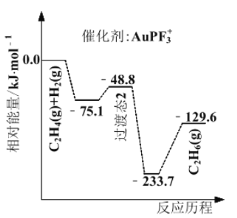
题目内容
【题目】将32.64g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请计算(写出计算过程):
(1)混合气体中NO和NO2的体积各位多少?______________
(2)被还原的硝酸的物质的量为多少?_________________
【答案】NO:5.8L NO2:5.4L 0.5mol
【解析】
根据氧化还原反应中电子转移守恒计算解答。
(1)Cu与HNO3反应过程中,Cu作还原剂失去的电子数等于HNO3作氧化剂得到的电子数,即得失电子守恒,有n(Cu)×2=n(NO)×3+n(NO2)×1,则![]() ,V(NO)+V(NO2)=11.2L联立解得:V(NO)=5.8L,V(NO2)=5.4L,故答案为:NO:5.8L NO2:5.4L;
,V(NO)+V(NO2)=11.2L联立解得:V(NO)=5.8L,V(NO2)=5.4L,故答案为:NO:5.8L NO2:5.4L;
(2)根据N原子守恒知,被还原的硝酸的物质的量等于生成的NO与NO2的物质的量,则n(HNO3)=![]() ,故答案为:0.5mol。
,故答案为:0.5mol。

 走进文言文系列答案
走进文言文系列答案【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
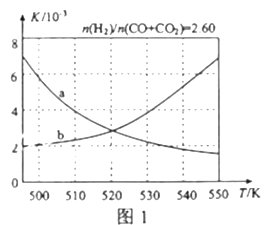
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.