题目内容
【题目】目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
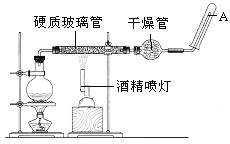
请回答下列的问题。
(1)铁在周期表中的位置是_______
(2)请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
① | ② | ③ | ④ | |
溶液中的金属离子 | Fe2+ | |||
残留固体成分 | Fe、Pt | Pt | Pt |
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a = ,b = ,
【答案】(1)第四周期,第Ⅷ 族
(2)3Fe+4H2O(g)![]() Fe3O4+4H2↑
Fe3O4+4H2↑
(3)2Al+Fe2O3![]() Al2O3 + 2Fe (答案合理即给分)
Al2O3 + 2Fe (答案合理即给分)
(4) ①
① | ② | ③ | ④ | |
溶液中的金属离子 | Fe2+ | Fe2+ | Fe2+Fe3+ | Fe3+ |
残留固体成分 | Fe、Pt | Pt | Pt | Pt |
②a =0.012,b = 0.02
【解析】试题分析::(1)Fe的原子序数为26,原子结构中有4个电子层,最外层电子数为2,则位于元素周期表中第四周期,第Ⅷ族,故答案为:第四周期,第Ⅷ族;
(2)Fe与水蒸气反应生成四氧化三铁和氢气,反应为3Fe+4H2O(g)![]() Fe3O4+4H2↑(3)铝和铁的氧化物反应生成氧化铝和Fe,反应为2Al+Fe2O3
Fe3O4+4H2↑(3)铝和铁的氧化物反应生成氧化铝和Fe,反应为2Al+Fe2O3![]() Al2O3 + 2Fe。(4)①随HNO3用量的增加,硝酸不足,发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,金属离子为Fe2+,残留固体成分为Fe、Pt;若硝酸与Fe恰好发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,金属离子为Fe2+,残留固体成分为Pt;在上述反应基础上,再加硝酸,发生3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,则金属离子为Fe2+Fe3+,残留固体成分为Pt;若亚铁离子恰好被氧化,则发生3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,则金属离子为Fe3+,残留固体成分为Pt;②x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,则物质的量均为0.25amol,由电子守恒可知,0.25a×2+0.25a×3=0.112/22.4×(5-2),解得a=0.012,由N原子守恒可知b=0.25×0.012mol×2+0.25×0.012mol×3+0.112/22.4=0.02。
Al2O3 + 2Fe。(4)①随HNO3用量的增加,硝酸不足,发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,金属离子为Fe2+,残留固体成分为Fe、Pt;若硝酸与Fe恰好发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,金属离子为Fe2+,残留固体成分为Pt;在上述反应基础上,再加硝酸,发生3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,则金属离子为Fe2+Fe3+,残留固体成分为Pt;若亚铁离子恰好被氧化,则发生3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,则金属离子为Fe3+,残留固体成分为Pt;②x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,则物质的量均为0.25amol,由电子守恒可知,0.25a×2+0.25a×3=0.112/22.4×(5-2),解得a=0.012,由N原子守恒可知b=0.25×0.012mol×2+0.25×0.012mol×3+0.112/22.4=0.02。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案