题目内容
用铁片与2mol/L稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是
| A.滴加NaCl溶液 | B.加热 |
| C.换用4mol/L硫酸 | D.换用铁粉 |
A
解析试题分析:A项滴加NaCl溶液会使硫酸的浓度减小,反应速率减慢,正确;B项加热会加快反应速率,错误;C项换用4mol/L硫酸将酸的浓度增大也加快了反应速率,错误;D项换用铁粉会增大固体反应物与酸溶液的接触面积,从而加快了反应速率,错误。
考点:考查化学反应速率的影响因素。

练习册系列答案
相关题目
(5分)在某容积可变的密闭容器中,有下列的可逆反应:A(g) + B(g)  xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线。若试判断对图2的说法中正确的是
xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线。若试判断对图2的说法中正确的是 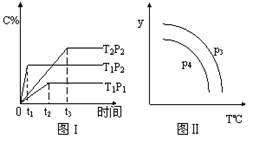
| A.P3>P4,y轴表示C的体积分数 |
| B.P3<P4,y轴表示B的质量分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
决定化学反应速率的主要因素是
| A.反应物的浓度 | B.反应温度 | C.使用催化剂 | D.反应物的性质 |
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如下图。下列叙述中正确的是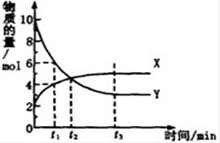
| A.反应的化学方程式为5Y?X |
| B.t1时,Y的浓度是X浓度的1.5倍 |
| C.t2时,正、逆反应速率相等 |
| D.t3时,逆反应速率大于正反应速率 |
在t℃时,10mL0.4mol·L-1H2O2溶液发生催化分解:2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表
| t /min | 0 | 2 | 4 | 6 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
A.0~2min H2O2平均反应速率比4~6min快
B.0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.3mol·L-1
D.反应至6min时,H2O2分解了50%
N2+3H2一定条件2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
| A.增加N2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
 2B(g)+C(g),若A的浓度由0.1 mol·L
2B(g)+C(g),若A的浓度由0.1 mol·L 降到0.06 mol·L
降到0.06 mol·L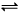 2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是
2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是  2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是