��Ŀ����
����Ŀ��������ͼ��ʾװ��(������������ȥ)�ش������й����⡣
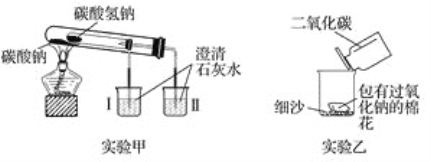
��1��ʵ����ڼ��ȹ������ܹ۲쵽������ɫ�������ձ���________(����������������)�����ձ��з�����Ӧ�Ļ�ѧ����ʽ��____________________________________��ͨ��ʵ���֤��_____________(����Na2CO3������NaHCO3��)���ȶ���
��2��ʵ��������̽��Na2O2��CO2�ķ�Ӧ���۲쵽��ʵ������Ϊ����Na2O2�����Ż�д��Na2O2��CO2��Ӧ�Ļ�ѧ����ʽ��______________________________�����Ż�˵���÷�Ӧ���ص���____________________________��
��3��ȡ10 g̼���ƺ�̼�����ƵĻ�����ּ��ȣ������ɵ�CO2����ͨ�������ij���ʯˮ�У�������ɳ���������Ϊ4.0 g����ԭ�������̼���Ƶ���������Ϊ________��
���𰸡� �� Ca(OH)2��CO2===CaCO3����H2O Na2CO3 2Na2O2��2CO2===2Na2CO3��O2 �ų��������� 32.8%
�������������������1��̼���Ƽ��Ȳ��ֽ⡢̼���������ȷֽ����̼���ơ�������̼��ˮ��������̼ʹ����ʯ��ˮ��롣��2�����������������̼��Ӧ���ȡ���3��4g����ΪCaCO3������n(CO2)=0.04mol��n(NaHCO3)=0.08mol��̼��������������Ϊ67.2%��

 ��У����ϵ�д�
��У����ϵ�д�