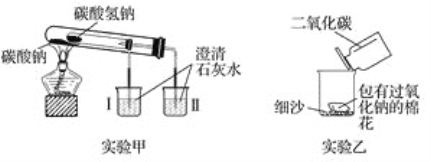
题目内容
【题目】把6.5gZn放入足量的稀盐酸中,锌完全反应.计算
(1)参加反应的HCl的物质的量.
(2)生成氢气的体积(标准状况).
【答案】
(1)解:锌和稀盐酸反应生成氯化锌和氢气,反应发生为 Zn+2HCl=ZnCl2+H2↑;参加反应的n(HCl)=2n(Zn)=2× ![]() =0.2mol,
=0.2mol,
答:参加反应的稀盐酸的物质的量是0.2mol
(2)解:锌和稀盐酸反应生成氯化锌和氢气,反应发生为 Zn+2HCl=ZnCl2+H2↑;参加反应的n(HCl)=0.2mol,生成氢气的物质的量是0.1mol,
体积V=nVm=0.1mol×22.4L/mol=2.24L,
答:生成氢气体积是2.24L
【解析】(1)根据锌和稀盐酸关系式计算参加反应的HCl的物质的量;(2)根据化学方程式计算生成氢气体积.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目