题目内容
高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂。湿法制备的离子反应方程式: 2Fe(OH)3+3ClO-+4OH-→ 2FeO42-+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2→2Na2FeO4+2Na2SO4。有关分析错误的是
| A.等物质的量Na2FeO4氧化能力优于次氯酸钠 |
| B.湿法中氢氧化铁被氧化 |
| C.干法中每生成1 mol Na2FeO4转移3 mol电子 |
| D.高铁酸钠的氧化性大于次氯酸钠 |
CD
试题分析:A.在体现氧化能力的过程中Na2FeO4到三价铁离子,次氯酸钠到氯离子,当等物质的量时转移的电子数Na2FeO4大于次氯酸钠的,故A正确。湿法中氢氧化铁中的铁元素化合价升高被氧化,正确。C.干法中每生成1 mol Na2FeO4应转移2 mol电子,错误。D.由2Fe(OH)3+3ClO-+4OH-→ 2FeO42-+3Cl-+5H2O反应再根据氧化剂的氧化性强于氧化产物的氧化性,高铁酸钠的氧化性弱于次氯酸钠,错误。

练习册系列答案
相关题目
 KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。 ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O Cu(NO3)2
Cu(NO3)2 CuO
CuO Cu(OH)2
Cu(OH)2 CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2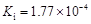



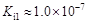 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,试配平上述化学方程式。
,试配平上述化学方程式。 KCl + MnCl2 + Cl2↑ + H2O
KCl + MnCl2 + Cl2↑ + H2O