��Ŀ����
����Ŀ����֪KMnO4��MnO2�����������¾��ܽ����� ��H2C2O4��������
�� i��MnO4��+H2C2O4+H+��Mn2++CO2��+H2O��δ��ƽ��
�� ii��MnO2+H2C2O4+2H+=Mn2++2CO2��+2H2O
ij�о�С��Ϊ�ⶨij���̿���MnO2������������ȷ��ȡ1.20g���̿���Ʒ������1.80g���ᣬ�ټ���������ϡ���Ტ���ȣ����ʲ��μӷ�Ӧ������ַ�Ӧ֮����ȴ����ȥ���ʣ���������Һת�Ƶ�����ƿ�в����ݣ�����ȡ��25.00mL����Һ������ƿ�У�����0.020molL��1KMnO4����Һ���еζ���������20.00mLKMnO4��Һʱǡ����ȫ��Ӧ���Իش��������⣺
�ٷ���ʽ�� i����ƽ��H2C2O4�ļ���ϵ��Ϊ ��
��0.020molL��1KMnO4����ҺӦ��������ס����ҡ����ζ����У��ζ��յ����ɫ�仯�� ��
�����ܷ�������о�С��������̿���MnO2�����������������ܡ������������������������˵��ԭ���ܡ��ļ�������ԭ��˵�� ��
������ʵ������д������в��������л�ʹ����MnO2����������ƫС���� ��
A���ζ�ǰ���첿����һ���ݣ��ζ��յ�ʱ��ʧ
B����Һת��������ƿ�У�δ���ձ�������ϴ��
C���ζ�ǰ���Ӷ������ζ����Ӷ���
D������ʱ�����ӿ̶���
E����ƿˮϴ֮��δ�ô���Һ��ϴ��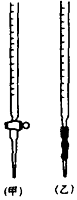
���𰸡�5���ף�����������һ��KMnO4��Һ����ƿ����Һ���������ɫ���Ұ���Ӳ���ɫ�����ﵽ�ζ��յ㣻����Ϊ��֪������ƿ�Ĺ��AD
���������⣺�ٷ�Ӧ��MnO4����Mn2+ �� ��Ԫ�ػ��ϼ���+7�۽���Ϊ+2�ۣ�������5�ۣ�H2C2O4��CO2 �� ̼Ԫ�ػ��ϼ���+3������Ϊ+4��������2�ۣ����ϼ���С������Ϊ10����MnO4��ϵ��Ϊ2��H2C2O4ϵ��Ϊ5���ٸ���Ԫ���غ��֪Mn2+ϵ��Ϊ2��CO2ϵ��Ϊ10�����ݵ���غ��֪H+ϵ��Ϊ16��������Ԫ���غ��֪H2Oϵ��Ϊ8����ƽ�����ӷ���ʽΪ2MnO4��+5H2C2O4+6H+=2Mn2++10CO2+8H2O�����Դ��ǣ�5���ڸ�����ؾ���ǿ�����ԣ�Ӧװ����ʽ�ζ����У�������ʽ�ζ��ܣ����Ǽ�ʽ�ζ��ܣ����������Ը�����ط���������ԭ��Ӧ�����ζ����յ�ʱ������ǡ����ȫ��Ӧ���ٵ���һ��KMnO4��Һ�����ɫ�����ɫ���Ұ���Ӳ���ɫ����˵���ﵽ�ζ��յ㣬���Դ��ǣ��ף�����������һ��KMnO4��Һ����ƿ����Һ���������ɫ���Ұ���Ӳ���ɫ�����ﵽ�ζ��յ㣻�����ڲ���������û�и�������ƿ�Ĺ���Ƕ��٣���֪�����Ƶ���Һ����������Դ��ǣ�����Ϊ��֪������ƿ�Ĺ�ܸ��ݷ�Ӧԭ�������ĵĸ�����ر�Һ���ƫ����������ĵIJ��������ƫ�����������ĵIJ�������ӻ�ƫС���ⶨ�Ķ������̵ĺ���ƫС�� A���ζ�ǰ���첿����һ���ݣ��ζ��յ�ʱ��ʧ���ζ�ǰ�����ݣ��ζ�ʱ���ĵĸ�����ر�Һ���ƫ�ⶨ�Ķ������̺���ƫ�ͣ���A��ȷ�� B����Һת��������ƿ�У�δ���ձ�������ϴ�ӣ�û��ϴ���ձ������������ᵼ�����Ƶ���Ʒ��Һ���������ʵ�����С���ζ������ĵĸ��������ҺƫС���ⶨ�Ķ������̵ĺ������ƫ�ߣ���B���� C���ζ�ǰ���Ӷ������ζ����Ӷ������ζ�ǰ���Ӷ�����������ƫ�ζ����Ӷ�����������ƫС�����ռ�����ƫС�����ĵĸ��������ҺƫС���ⶨ�Ķ������̺���ƫ�ߣ���C���� D������ʱ�����ӿ̶��ߣ��ᵼ�����Ƶ���Ʒ��Һ�����ƫС����Һ��Ũ��ƫ���ø��������Һ�ζ�ʱ�����ĵĸ��������Һ�����ƫ�ⶨ�Ķ������̺���ƫ�ͣ���D��ȷ�� E����ƿˮϴ֮��δ�ô���Һ��ϴ����ƿ����Ҫ��ϴ���˲�����ȷ���Եζ����û��Ӱ�죬��E�������Դ��ǣ�AD��
�����㾫����ͨ�������������к͵ζ��������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㼴���Խ����⣮

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�

