题目内容
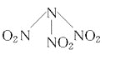
【题目】在100mL混合液中,HNO3和H2SO4物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92gCu粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( )
A.0.15 mol/LB.0.3 mol/LC.0.1 mol/LD.0.225 mol/L
【答案】D
【解析】
溶液中的氢离子包括硝酸电离和硫酸电离的,因为硝酸和硫酸都是强酸,所以溶液中的氢离子的物质的量为:0.4mol/L×0.1L+0.1mol/L×0.1L×2=0.06mol,硝酸根离子的物质的量为:0.4mol/L×0.1L=0.04mol,1.92gCu的物质的量为:![]() ,则3Cu+8H++NO3-=2NO↑+3Cu2++4H2O,结合氢离子、铜、硝酸根离子的物质的量和铜与稀硝酸反应的离子方程式可知,氢离子的物质的量不足,根据氢离子的物质的量计算,反应中有0.06mol氢离子参加反应,则参加反应的铜的物质的量为:0.06:n(Cu) = 8:3,n(Cu) =0.0225mol,则反应生成Cu2+的物质的量为0.0225mol,故所得溶液中Cu2+的物质的量浓度是
,则3Cu+8H++NO3-=2NO↑+3Cu2++4H2O,结合氢离子、铜、硝酸根离子的物质的量和铜与稀硝酸反应的离子方程式可知,氢离子的物质的量不足,根据氢离子的物质的量计算,反应中有0.06mol氢离子参加反应,则参加反应的铜的物质的量为:0.06:n(Cu) = 8:3,n(Cu) =0.0225mol,则反应生成Cu2+的物质的量为0.0225mol,故所得溶液中Cu2+的物质的量浓度是![]() ,D符合题意;
,D符合题意;
答案选D。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目