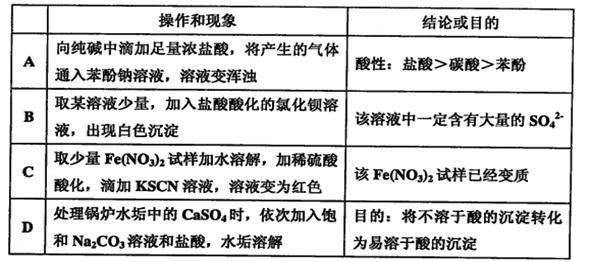
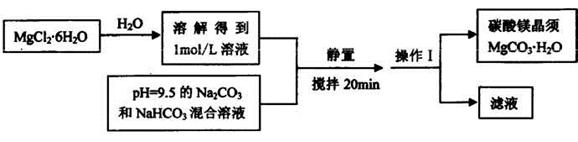
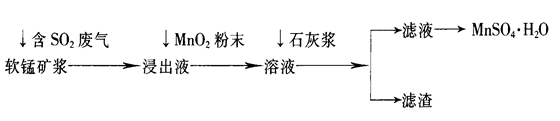
题目内容
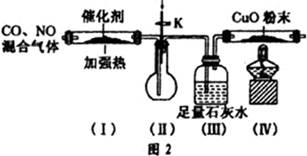
已知亚硫酸的酸性强于碳酸。现有CO2气体中含少量SO2,欲得到干燥纯净的CO2,通过如图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是
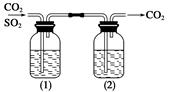

| A.(1)NaOH;(2)浓H2SO4 | B.(1)浓H2SO4;(2)NaOH |
| C.(1)NaHCO3;(2)浓H2SO4 | D.(1)浓H2SO4;(2)Na2CO3 |
C
试题分析:A、NaOH既能吸收SO2,又能吸收CO2,(1)中除杂试剂不能与被提纯物反应,错误;B、浓硫酸只能干燥CO2,不能除去SO2,错误;C、亚硫酸的酸性比碳酸强,则足量的饱和碳酸氢钠溶液能除去SO2,且使CO2增多,浓硫酸能除去水,正确;D、虽然碳酸钠溶液能除去SO2,但是CO2也能与之反应,且有水蒸气逸出,故得不到干燥纯净的CO2,错误。2和SO2、氢氧化钠、碳酸氢钠、碳酸钠、浓硫酸的性质等相关知识。

练习册系列答案
相关题目
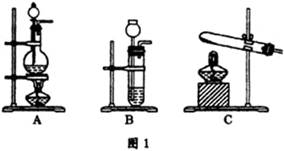
 CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为