题目内容
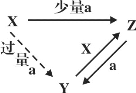
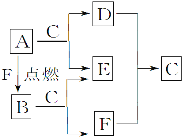
【题目】A、D、F均是由短周期元素组成的单质,常温下C是液体, D、F为气体,A、B、E为固体,其中B为淡黄色固体。
请回答下列问题:
(1)B和E的化学式:B________,E________。
(2)A与C反应的离子方程式为____________________________________________________________。
(3)下列关于A的叙述正确的是________(填序号)。
①A有很强的还原性 ②A的焰色反应呈紫色
③少量A可以保存在冷水里 ④A着火时应选用泡沫灭火器
(4)将A、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积之比是________(填序号)。
①1∶2∶3 ②6∶3∶2 ③3∶1∶1 ④1∶1∶1
【答案】Na2O2NaOH2Na+2H2O===2Na++2OH-+H2↑①③
【解析】
A、D、F均是由短周期元素组成的单质,常温下C是液体判断为H2O,A在F中燃烧产物B能和水反应生成单质F,推断F为O2,则A为Na,B为Na2O2,E为NaOH,D为H2。
(1)分析可知B为过氧化钠,E为氢氧化钠。
(2)A与C反应为钠和水反应生成氢氧化钠和氢气。
(3)A为Na是活泼金属、具有很强的还原性,焰色反应为黄色,与水、二氧化碳等发生反应。
(4)钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应,不与水发生反应,据题给信息分析出钠完全反应,而镁、铝过量,据以上分析解答。
A、D、F均是由短周期元素组成的单质,常温下C是液体判断为H2O,A在F中燃烧产物B能和水反应生成单质F,推断F为O2,则A为Na,B为Na2O2,E为NaOH,D为H2;
(1)通过以上分析可知B为过氧化钠,化学式为:Na2O2,E为氢氧化钠,化学式为:NaOH;正确答案:Na2O2 ;NaOH。
(2)A与C反应为钠和水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O===2Na++2OH-+H2↑ ;正确答案:2Na+2H2O=2Na++2OH-+H2↑。
(3)A为Na是活泼金属、具有很强的还原性,焰色反应为黄色,与水、二氧化碳等发生反应;①Na是活泼金属有很强的还原性,故①正确;②Na的焰色反应呈黄色,故②错误;③钠和水剧烈反应,少量Na可以保存在煤油里,故③错误;④钠和二氧化碳能发生反应,Na着火时不能选用泡沫灭火器,故④错误;正确选项①。
(4)钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,根据2Na~H2↑可知,0.3molNa完全反应,生成氢气的物质的量=0.3mol×12=0.15mol,镁和铝都剩余,所以二者与酸反应生成氢气的量相等,生成根据氢原子守恒得生成氢气的量=0.1mol2=0.05mol,所以同温同压下产生的气体的物质的量之比=0.15mol:0.05mol:0.05mol=3:1:1;正确选项:③。

 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】对下列物质中杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是
选项 | 物质及其杂质 | 检验 | 除杂 |
A | Na2O2(Na2O) | 水 | 水 |
B | NO(NO2) | 观察颜色 | 水 |
C | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
D | HCl(Cl2) | 观察颜色 | 排饱和食盐水 |
A.AB.BC.CD.D