��Ŀ����
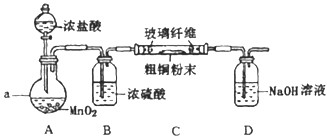
5��ʵ���ҿ��Ի��������е㣺160.84�棬��ˮ���ܽ�Ƚ�С���Ʊ�����ͪ���е㣺155.6�棬����ˮ����ʹ�õ������������Ǵ������ơ��ظ���صȣ�ͼ1��������װ�ã�ͼ2���ֱ��Dz�Ʒ�ĺϳ�װ�ú;���װ��ʾ��ͼ��
ʵ���������

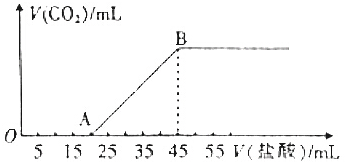
��1���ںϳ�װ���У�Cװ�õ������ǣ�ֱ�Σ������ܣ���װ�н���������Һ©�����¶ȼƵ�250mL���100mL����250mL����������ƿ�����μ���5.2ml ��5g��0.05mol����������25ml�����ᣮ��Һ©����������Ľṹ����ҪĿ����ƽ��ѹ����ʹ����Һ����˳������������ƿ�У�
��2����������������38ml����������Һ��Լ1.8mol/L��ͨ����Һ©�����뵽��Ӧƿ�У���ʹƿ���¶�ά����30��35�棬������ô��Խ���������5min��
��3�����õ⻯�ص�����ֽ���鷴ӦҺ��������������������IJ���Ӧ���Ǽ�������һ�����Ĵ���������Һ����֤��������ȫ��������
��4�����õ⻯�ص�����ֽ���鷴ӦҺ������ɫ��д���й����ӷ���ʽ2CH3COOH+C1O-+2I-=Cl-+I2+H2O+2CH3COO-��Ȼ���������¼�������30min�����뱥��NaHSO3��Һ����ӦҺ�Ե⻯�ص�����ֽ������ɫΪֹ��
��5�������ںϳ�װ���м���30mlˮ��3g�Ȼ����ͼ�����ʯ���������������Һ������γ�Ϊֹ��
��6��������ɺ������Һ�з���������ˮ̼��������ӦҺ������Ϊֹ��Ȼ����뾫��ʳ��ʹ֮��ɱ�����Һ�������Һ�����Һ©���У�����õ��л��㣮
��7���Ѵֲ�Ʒ�ò�Ʒ����װ�ã�ͼ2�ң��������ռ�155.6�����ҵ���֣�
��8��Ϊ��˵������ͪ�Ƿ����ȽϺ����ķ����Ǽ����ý����ƻ�����KMnO4������K2Cr2O7�Լ���
���� ��1���ںϳ�װ���У�Cװ���������ܣ�������ƿ�����μ���5.2mL��������25mL�����ᣬ40mL����������Һ�����뵽��Ӧƿ�У��ټ���30mLˮ�ȣ�����Ҫ��250mL��������������ƿ����Һ©���е����������ܿ���ƽ���Һ©����������������е�ѹǿ��
��3���õ⻯�ص�����ֽ���鷴ӦҺ������������˵������������Һ���������㣬���ܻ����δ�������Ļ����飻
��4�����õ⻯�ص�����ֽ���鷴ӦҺ������ɫ˵������Һ�д���������Һ����������������Ϊ�ⵥ�ʣ�
��6����Ϊ��ʵ������м����˱����ᣬ���Լ�����ˮ̼���ƿ������ɳɴ����ƣ��Ӷ��������Ʒ���룬�������ֻ����ܵ�Һ������÷�Һ©����
��7������ͪ�ķе�Ϊ155.6�棬�����ھ���ʱӦ���ռ�155.6�����֣�
��8������ͪ�п����е�������Ҫ�ǻ����������Լ����Ƿ��л����������ý����ƣ����Ƿ������������
��� �⣺��1���ںϳ�װ���У�Cװ���ǣ�ֱ�Σ������ܣ�������ƿ�����μ���5.2mL��������25mL�����ᣬ40mL����������Һ�����뵽��Ӧƿ�У��ټ���30mLˮ�ȣ�����Ҫ��250mL��������������ƿ����Һ©���е����������ܿ���ƽ���Һ©����������������е�ѹǿ��ʹ����Һ����˳����������ƿ�У�
�ʴ�Ϊ�������ܣ�250mL��ƽ��ѹ����ʹ����Һ����˳������������ƿ�У�������
��3���õ⻯�ص�����ֽ���鷴ӦҺ������������˵������������Һ���������㣬���ܻ����δ�������Ļ����飬��������IJ���Ӧ���Ǽ�������һ�����Ĵ���������Һ����֤��������ȫ��������
�ʴ�Ϊ����������һ�����Ĵ���������Һ����֤��������ȫ��������
��4�����õ⻯�ص�����ֽ���鷴ӦҺ������ɫ˵������Һ�д���������Һ����������������Ϊ�ⵥ�ʣ���Ӧ�����ӷ���ʽΪ��2CH3COOH+C1O-+2I-=Cl-+I2+H2O+2CH3COO-��
�ʴ�Ϊ��2CH3COOH+C1O-+2I-=Cl-+I2+H2O+2CH3COO-��
��6����Ϊ��ʵ������м����˱����ᣬ���Լ�����ˮ̼���ƿ������ɳɴ����ƣ��Ӷ��������Ʒ���룬�������ֻ����ܵ�Һ������÷�Һ©����
�ʴ�Ϊ����Һ©����
��7������ͪ�ķе�Ϊ155.6�棬�����ھ���ʱӦ���ռ�155.6�����֣�
�ʴ�Ϊ��155.6��
��8������ͪ�п����е�������Ҫ�ǻ����������Լ����Ƿ��л����������ý����ƻ�����KMnO4������K2Cr2O7�����Ƿ��������������Һ�Ƿ���ɫ��
�ʴ�Ϊ���ý����ƻ�����KMnO4������K2Cr2O7��
���� �����Ի���ͪ�Ʊ�Ϊ���壬���黯ѧʵ������������л�������ʵȣ���Ŀ�Ѷ��еȣ������ڶ�ѧ��ʵ����������Ŀ��飮

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�| A�� | Ư�� | B�� | Һ�� | C�� | ���� | D�� | ���� |