题目内容
【题目】从石油裂解中得到的1,3-丁二烯可进行以下多步反应,得到氯丁橡胶和富马酸。
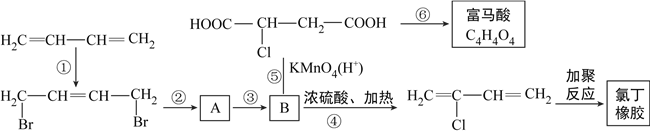
(1)B的名称为2-氯-1,4-丁二醇,请你写出B的结构简式____________________。
(2)请你写出第②步反应的化学方程式:______________________________。
(3)反应①~⑥中,属于消去反应的有______________________________。
(4)有机合成中的路线和步骤选择非常重要,若将第②步和第③步的顺序调换,则B结构将是____________________。
(5)如果没有设计③和⑥这两步,直接用KMnO4/H+处理物质A,导致的问题是:______________________________。
(6)某种有机物的分子式为C5H6O4,它的分子中所含官能团的种类、数目均与富马酸相同,不考虑顺反异构,它可能的结构有__________种。
【答案】 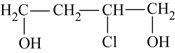
 +2NaOH
+2NaOH![]()
 +2NaBr ④⑥
+2NaBr ④⑥  碳碳双键也会被氧化 5
碳碳双键也会被氧化 5
【解析】(1)根据B的名称可得B的结构简式为![]() 。
。
(2)根据流程可知:BrCH2CH=CHCH2Br经过两步反应得到![]() ,根据官能团的变化可知,反应②为-Br水解为-OH,则A为HOCH2CH=CHCH2OH;反应③为A与HCl加成生成B。根据上述分析,反应②为BrCH2CH=CHCH2Br在NaOH的水溶液、加热的条件下水解生成HOCH2CH=CHCH2OH,化学方程式为:BrCH2CH=CHCH2Br +2NaOH
,根据官能团的变化可知,反应②为-Br水解为-OH,则A为HOCH2CH=CHCH2OH;反应③为A与HCl加成生成B。根据上述分析,反应②为BrCH2CH=CHCH2Br在NaOH的水溶液、加热的条件下水解生成HOCH2CH=CHCH2OH,化学方程式为:BrCH2CH=CHCH2Br +2NaOH![]() HOCH2CH=CHCH2OH +2NaBr。
HOCH2CH=CHCH2OH +2NaBr。
(3)反应①是CH2=CH-CH=CH2与Br2发生1,4-加成,生成BrCH2CH=CHCH2Br;反应②为水解反应(取代反应);反应③为加成反应;根据反应④产物可知,反应④为B在浓硫酸、加热的条件下发生消去反应;根据反应条件及反应产物可知,反应⑤为氧化反应;反应⑥为HOOC-CHCl-CH2-COOH→C4H4O4,分析二者分子式可知,反应⑥为消去反应。故答案为:④⑥。
(4)反应②为水解反应,BrCH2CH=CHCH2Br→HOCH2CH=CHCH2OH,反应③为加成反应HOCH2CH=CHCH2OH→![]() 。若将反应②和反应③调换顺序,即先BrCH2CH=CHCH2Br与HCl加成生成
。若将反应②和反应③调换顺序,即先BrCH2CH=CHCH2Br与HCl加成生成![]() ;再发生水解反应,所得产物应为
;再发生水解反应,所得产物应为![]() 。
。
(5)反应⑥为消去反应,则富马酸的结构简式为HOOC-CH=CH-COOH。如果省去步骤③和⑥,直接用KMnO4/H+处理物质A(HOCH2CH=CHCH2OH),碳碳双键也能被高锰酸钾氧化,则得不到富马酸。故答案为:碳碳双键也会被氧化。
(6)富马酸含有2个-COOH和1个碳碳双键,该有机物为富马酸的同系物,且比富马酸多1个碳原子。该有机物可能的结构有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,共5种。
,共5种。
故答案为:5。

【题目】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.
(1)砷与磷为同一主族元素,磷的原子结构示意图为 .
(2)根据元素周期律,下列说法正确的是 .
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3 , 同时生成SO42﹣ , 导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为 .
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果: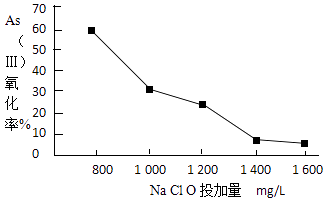
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是 .
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO3﹣ | HAsO42﹣ | HAsO42﹣、AsO43﹣ |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是 .
【题目】PCl5(g)一定条件下可以转化成PCl3(g)或红磷P(s).
(1)已知: PCl5(g)═PCl3(g)+Cl2(g)△H1K1
PCl3(g)═P(s)+ ![]() Cl2(g)△H2K2
Cl2(g)△H2K2
K1、K2表示该反应的平衡常数.
则PCl5(g)═P(s)+ ![]() Cl2(g)该反应的△H=(用△H1、△H2表示),反应的平衡常数K=(用K1、K2表示).
Cl2(g)该反应的△H=(用△H1、△H2表示),反应的平衡常数K=(用K1、K2表示).
(2)在210℃时,将4mol PCl3气体充入1L真空恒容密闭容器中发生反应:2PCl3(g)═2P(s)+3Cl2(g) 测得数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 4 | 2.8 | 2 | 1 | 1 |
并测得反应达到平衡时热量变化数值为Q,反应平衡常数为K,PCl3转化率为α.
①0~30min时,用Cl2表示该反应的反应速率为;平衡时,PCl3转化率α=;该温度下反应的平衡常数K= .
②其它条件保持不变,若上述反应在恒压条件下进行反应,达平衡时测得热量变化数值、平衡常数、PCl3转化率分别为Q′、K′、α′,则Q′(填“>”“<”或“=”,下同)Q,K′K,α′α.
③保持其它条件不变,若向上述平衡体系中再充入1molCl2(g)、1molP(s)和1molPCl3(g),则上述平衡反应(填“正向”、“逆向”或“不”)移动.