��Ŀ����
�ȣ�Sr��Ϊ�������ڢ�A��Ԫ�أ��仯������ˮ�Ȼ��ȣ�SrCl2��6H2O����ʵ������Ҫ�ķ����Լ�����ҵ�ϳ�������ʯ����Ҫ�ɷ�ΪSrSO4��Ϊԭ���Ʊ��������������£�
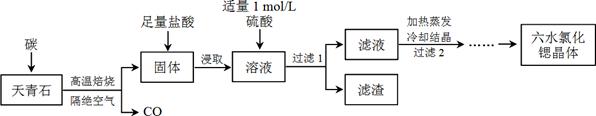
��֪���� �������ȡ����Һ�г�����Sr2+��Cl���⣬����������Ba2+���ʣ�
�� SrSO4��BaSO4���ܶȻ������ֱ�Ϊ3.3��10��7��1.1��10��10��
�� SrCl2��6H2O��Ħ������Ϊ��267 g/mol��
��1������ʯ����ǰ����ĥ���飬��Ŀ����_________________________________________��
��2�������������±��գ���0.5 mol SrSO4��ֻ��S����ԭ��ת����4 mol���ӡ�д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________________________________��
��3��Ϊ�˵õ��ϴ�����ˮ�Ȼ��Ⱦ��壬����2������е�����������_______________��
��4�����������Ŀ����______________________��Ϊ�����ԭ�ϵ������ʣ���Һ��Sr2+��Ũ��Ӧ������_________ mol/L��ע����ʱ��Һ��Ba2+Ũ��Ϊ1��10��5 mol/L����
��5����Ʒ���ȼ�⣺��ȡ1.000 g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO3 1.100��10��2 mol��AgNO3��Һ����Һ�г�Cl�D�⣬����������Ag+��Ӧ�����ӣ�����Cl�D��ȫ�������ú�Fe3+����Һ��ָʾ������0.2000 mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+ ��AgSCN��ɫ��������ʽ������
�ٵζ���Ӧ�ﵽ�յ��������_________________________________________��
�����ζ�������ȥ����Ũ�ȵ�NH4SCN��Һ20.00 mL�����Ʒ��SrCl2��6H2O�������ٷֺ���Ϊ______________������4λ��Ч���֣���

��֪���� �������ȡ����Һ�г�����Sr2+��Cl���⣬����������Ba2+���ʣ�
�� SrSO4��BaSO4���ܶȻ������ֱ�Ϊ3.3��10��7��1.1��10��10��
�� SrCl2��6H2O��Ħ������Ϊ��267 g/mol��
��1������ʯ����ǰ����ĥ���飬��Ŀ����_________________________________________��
��2�������������±��գ���0.5 mol SrSO4��ֻ��S����ԭ��ת����4 mol���ӡ�д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________________________________��
��3��Ϊ�˵õ��ϴ�����ˮ�Ȼ��Ⱦ��壬����2������е�����������_______________��
��4�����������Ŀ����______________________��Ϊ�����ԭ�ϵ������ʣ���Һ��Sr2+��Ũ��Ӧ������_________ mol/L��ע����ʱ��Һ��Ba2+Ũ��Ϊ1��10��5 mol/L����
��5����Ʒ���ȼ�⣺��ȡ1.000 g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO3 1.100��10��2 mol��AgNO3��Һ����Һ�г�Cl�D�⣬����������Ag+��Ӧ�����ӣ�����Cl�D��ȫ�������ú�Fe3+����Һ��ָʾ������0.2000 mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+ ��AgSCN��ɫ��������ʽ������
�ٵζ���Ӧ�ﵽ�յ��������_________________________________________��
�����ζ�������ȥ����Ũ�ȵ�NH4SCN��Һ20.00 mL�����Ʒ��SrCl2��6H2O�������ٷֺ���Ϊ______________������4λ��Ч���֣���
��1������ʯ����ǰ����ĥ���飬��Ŀ����Ϊ�����ӷ�Ӧ��ĽӴ���������ѧ��Ӧ���ʡ�
��2��SrSO4 + 4C SrS + 4CO��
SrS + 4CO��
��3��ϴ�ӡ�������ɣ�
��4����ȥ��Һ��Ba2+���� 0.03
��5����Һ����ɫ��ΪѪ��ɫ����30 s����ɫ 93.45%
��2��SrSO4 + 4C
 SrS + 4CO��
SrS + 4CO����3��ϴ�ӡ�������ɣ�
��4����ȥ��Һ��Ba2+���� 0.03
��5����Һ����ɫ��ΪѪ��ɫ����30 s����ɫ 93.45%
�����������1������ʯ����ǰ����ĥ���飬��Ŀ����Ϊ�����ӷ�Ӧ��ĽӴ���������ѧ��Ӧ���ʣ��Ӷ����ԭ�ϵ�ת���ʡ���2���ڱ��յĹ�������ֻ��0.5 mol SrSO4��ֻ��S����ԭ��ת����4 mol���ӣ���1mol��Sת��8mol�ĵ��ӣ������ڷ�ӦǰԪ�صĻ��ϼ�Ϊ+6�ۣ����Է�Ӧ��Ԫ�صĻ��ϼ�Ϊ-2�ۡ����̼������ʯ�ڸ����·�����ӦSrSO4 + 4C
 SrS + 4CO������3��Ȼ����õ��ĺ���SrS�����м���HCl������Ӧ��SrS+2HCl= SrCl2+H2S��������Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��TSrCl2��6H2O����4������HCl�ܽ�SrS�����Һ�м��������Ŀ���dz�ȥ��Һ��Ba2+���ʡ�������Ba2+Ũ��Ϊ1��10��5 mol/L��BaSO4���ܶȻ�����Ϊ1.1��10��10������c(SO42-)=1.1��10��10��1��10��5=1.1��10��5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10��7������c(Sr2+)=3.3��10��7��1.1��10��5=3.0��10��2=0.03mol/L����5����NH4SCN����ʣ���Ag+ ����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN�����ͻ���Fe3+�������������Һ��Ϊ��ɫ����˵ζ��ﵽ�յ�ʱ��Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��n(NH4SCN)="0.2000" mol/L��0.02L=4.0��10-3mol��������Һ��ʣ���Ag+�����ʵ���Ϊn(Ag+)=4.0��10-3mol,�����Cl�D��Ӧ��Ag+�����ʵ���Ϊn(Ag+)=1.100��10��2 mol��4.0��10-3mol=7.0��10-3mol n(SrCl2��6H2O)=3.5��10-3mol,m(SrCl2��6H2O)= 3.5��10-3mol��267 g/mol=0.9345g.���Բ�Ʒ����Ϊ0.9345g��1g��100%=93.45%.
SrS + 4CO������3��Ȼ����õ��ĺ���SrS�����м���HCl������Ӧ��SrS+2HCl= SrCl2+H2S��������Һ����Ũ������ȴ�ᾧ��Ȼ�����Һ�н�������˳�����ϴ�ӳ�ȥ������������Ӳ����и��TSrCl2��6H2O����4������HCl�ܽ�SrS�����Һ�м��������Ŀ���dz�ȥ��Һ��Ba2+���ʡ�������Ba2+Ũ��Ϊ1��10��5 mol/L��BaSO4���ܶȻ�����Ϊ1.1��10��10������c(SO42-)=1.1��10��10��1��10��5=1.1��10��5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10��7������c(Sr2+)=3.3��10��7��1.1��10��5=3.0��10��2=0.03mol/L����5����NH4SCN����ʣ���Ag+ ����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN�����ͻ���Fe3+�������������Һ��Ϊ��ɫ����˵ζ��ﵽ�յ�ʱ��Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��n(NH4SCN)="0.2000" mol/L��0.02L=4.0��10-3mol��������Һ��ʣ���Ag+�����ʵ���Ϊn(Ag+)=4.0��10-3mol,�����Cl�D��Ӧ��Ag+�����ʵ���Ϊn(Ag+)=1.100��10��2 mol��4.0��10-3mol=7.0��10-3mol n(SrCl2��6H2O)=3.5��10-3mol,m(SrCl2��6H2O)= 3.5��10-3mol��267 g/mol=0.9345g.���Բ�Ʒ����Ϊ0.9345g��1g��100%=93.45%.
��ϰ��ϵ�д�
 ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
�����Ŀ