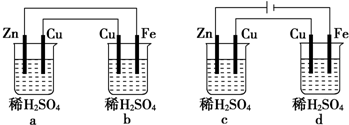
题目内容
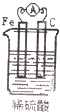
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
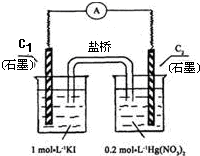
| A.如图装置的电流方向是从C1到C2 |
| B.C1是负极,发生的反应是2I-═I2+2e- |
| C.K+离子向C1电极流动 |
| D.装置发生的总反应是Hg2++2I-═HgI2↓ |

电流计指针发生了偏转,说明有电流形成,证明形成了原电池反应,碘离子具有还原性,C1做负极,失电子生成碘单质,电极反应为2I--2e-═I2;C2做正极,溶液中汞离子得到电子发生还原反应,电流方向是从正极流向负极;
A、分析可知C1为负极,C2为正极,电流是从正极C2流向负极C1,故A错误;
B、C1是负极,发生的反应是2I--2e-═I2,故B正确;
C、盐桥中阳离子移向硝酸汞溶液中,向C2电极移动,故C错误;
D、装置中发生的反应是原电池反应为氧化还原反应,选项中的反应不是氧化还原反应,电荷不守恒,故D错误;
故选:B.
A、分析可知C1为负极,C2为正极,电流是从正极C2流向负极C1,故A错误;
B、C1是负极,发生的反应是2I--2e-═I2,故B正确;
C、盐桥中阳离子移向硝酸汞溶液中,向C2电极移动,故C错误;
D、装置中发生的反应是原电池反应为氧化还原反应,选项中的反应不是氧化还原反应,电荷不守恒,故D错误;
故选:B.

练习册系列答案
相关题目