题目内容
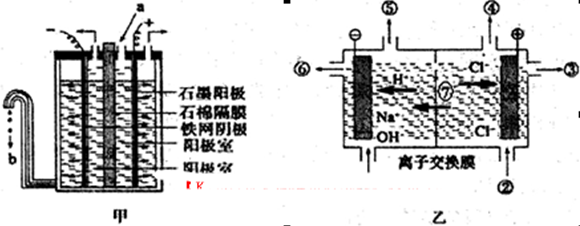
如图所示装置中,已知电子由b极沿导线流向锌.下列判断正确的是( )
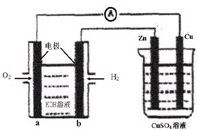
| A.该装置中Cu极为阴极 |
| B.一段时间后锌片质量减少 |
| C.b极反应的电极反应式为:H2-2e-+20H-=2H2O |
| D.当铜极的质量变化为32g时,a极上消耗的O2的体积为5.6L |

A.根据电子流向及燃料电池知,a电极是原电池正极,则铜电极是电解池阳极,故A错误;
B.根据电子流向及燃料电池知,b电极是原电池负极,则锌电极是电解池阴极,阴极上铜离子得电子析出铜,所以锌电极质量增加,故B错误;
C.b电极上氢气失电子和氢氧根离子反应生成水,所以其电极反应式为:H2-2e-+20H-=2H2O,故C正确;
D.根据转移电子守恒知,当铜极的质量变化为32g时,a极上消耗的O2的物质的量=
=0.25mol,因为温度和压强未知,无法判断压强的体积,故D错误;
故选C.
B.根据电子流向及燃料电池知,b电极是原电池负极,则锌电极是电解池阴极,阴极上铜离子得电子析出铜,所以锌电极质量增加,故B错误;
C.b电极上氢气失电子和氢氧根离子反应生成水,所以其电极反应式为:H2-2e-+20H-=2H2O,故C正确;
D.根据转移电子守恒知,当铜极的质量变化为32g时,a极上消耗的O2的物质的量=
| ||
| 4 |
故选C.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目