题目内容
已知:
(1)2Fe3++2I-═2Fe2++I2
(2)Br2+2Fe2+═2Fe3++2Br-
由此推断氧化剂的氧化性强弱顺序为( )
(1)2Fe3++2I-═2Fe2++I2
(2)Br2+2Fe2+═2Fe3++2Br-
由此推断氧化剂的氧化性强弱顺序为( )
| A、Br2>Fe3+>I2 |
| B、Fe3+>Br2>I2 |
| C、I2>Br2>Fe3+ |
| D、Br2>I2>Fe3+ |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此分析解答.
解答:
解:①2Fe3++2I-=2Fe2++I2中,该反应中氧化剂是Fe3+,气化产物是I2,则氧化性Fe3+>I2,
②2Fe2++Br2=2Fe3++2Br-中,氧化剂是Br2,氧化产物是Fe3+,则氧化性Br2>Fe3+,
所以氧化性强弱顺序是Br2>Fe3+>I2,
故选A.
②2Fe2++Br2=2Fe3++2Br-中,氧化剂是Br2,氧化产物是Fe3+,则氧化性Br2>Fe3+,
所以氧化性强弱顺序是Br2>Fe3+>I2,
故选A.
点评:本题考查了还原性强弱的判断,明确还原性强弱的判断方法是解本题关键,难度中等.

练习册系列答案
相关题目
NO2溶于水时的反应是:3NO2+H2O=2HNO3+NO,在该反应中氧化剂和还原剂的分子个数之比是( )
| A、3:1 | B、2:1 |
| C、1:2 | D、1:3 |
在相同温度下,100mL 0.1mol?L-1的醋酸与10mL 1mol?L-1的醋酸相比较,下列说法正确的是( )
| A、溶液中H+的物质的量前者大于后者 |
| B、前者的电离程度小于后者 |
| C、发生中和反应时所需NaOH的量前者大于后者 |
| D、溶液中CH3COOH的物质的量前者大于后者 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
| A、1.0L 1mol?L-1氨水中,NH3?H2O的分子数为6.02×1023 |
| B、当有7.1g Cl2和水完全反应时转移的电子数为0.1×6.02×1023 |
| C、白磷分子(P4)呈正四面体结构,31g白磷中含有P-P键个数为6×6.02×1023 |
| D、20g重水(2H216O)中含有的中子数为8×6.02×1023 |
在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)?4C(g),达平衡时c(A)=1.00
mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是( )
mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是( )
| A、系数x>2 | ||
| B、若增大该体系的压强,平衡向左移动,化学平衡常数变小 | ||
| C、若增大该体系的压强,平衡向右移动,化学平衡常数不变 | ||
D、该反应的化学平衡常数表达式是K=
|
不可能因发生化学反应而使溴水褪色的是( )
| A、乙烯 | B、氢氧化钾溶液 |
| C、二氧化硫 | D、苯 |
几种短周期元素的原子半径及主要化合价如下表:下列说法正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 140 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X、Y元素的金属性X<Y |
| B、一定条件下,Z单质与W的常见单质直接生成ZW |
| C、Y的氢氧化物能溶于稀氨水 |
| D、一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.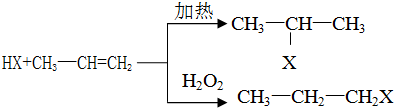
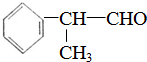 的一种香料.
的一种香料.