题目内容
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.I.图1、图2分别是实验室模拟合成氨及氨催化氧化的装置
(1)氮气和氢气通过图1装置,该装置中浓硫酸的作用是控制气体流速和
(2)用图2装置吸收一段时间氨后,再通入空气,同时将已经加热的铂丝插入乙装置的锥形瓶内,铂丝保持红热的原因是
Ⅱ.下列有关硝酸事实的解释合理的是
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化亚铁离子
C.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性
D.不用锌与稀硝酸反应制取氢气,说明稀硝酸能将锌钝化
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.
(1)工业上常用Na2CO3溶液吸收法处理NOx.
已知:NO不能与Na2CO3溶液反应
NO+NO2+Na2CO3═2NaNO2+CO2 ①
2NO2+Na2CO3═NaNO2+NaNO3+CO2 ②
用足量的Na2CO3溶液完全吸收NOx,每产生5.6L(标准状况)CO2(全部逸出)时,吸收液质量就增加10g,则NOx中的x值为
(2)尿素也可用于吸收处理NOx,其反应原理为:NO+NO2+H2O═2HNO2
2HNO2+CO(NH2)2═2N2↑+CO2↑+3H2O.
当混合气体中NO、NO2按上述反应中系数比时吸收效果最佳.若混合气体中V(NO):V(NO2)=3:1时,可通入一定量的空气,同温同压下,V(空气):V(NO)=
考点:性质实验方案的设计,硝酸的化学性质
专题:实验题
分析:I.(1)浓硫酸可用于干燥气体;
(2)氨气在被氧化生成NO,为放热反应,通入氧气,在溶液中生成硝酸;
Ⅱ.硝酸具有强氧化性和不稳定性,常温下与铝、铁发生钝化反应,保存时应避光;
(1)当NOx被Na2CO3溶液完全吸收时,则n(NO2)≥n(NO),利用差量法计算NO、NO2的物质的量,再根据平均摩尔质量法计算x值;
(2)若混合气体中V(NO):V(NO2)=3:1时,应通入一定量空气,达到混合气体中V(NO):V(NO2)=1:1.
(2)氨气在被氧化生成NO,为放热反应,通入氧气,在溶液中生成硝酸;
Ⅱ.硝酸具有强氧化性和不稳定性,常温下与铝、铁发生钝化反应,保存时应避光;
(1)当NOx被Na2CO3溶液完全吸收时,则n(NO2)≥n(NO),利用差量法计算NO、NO2的物质的量,再根据平均摩尔质量法计算x值;
(2)若混合气体中V(NO):V(NO2)=3:1时,应通入一定量空气,达到混合气体中V(NO):V(NO2)=1:1.
解答:
解:I.(1)浓硫酸具有吸水性,可用于干燥气体,故答案为:干燥混合气体;
(2)氨气在被氧化生成NO,为放热反应,反应的方程式为4NH3+5O2
4NO+6H2O,通入氧气,在溶液中生成硝酸,进而在溶液中生成硝酸铵,则溶液中含有的离子有NH4+和NO3-等,
故答案为:反应为放热反应;4NH3+5O2
4NO+6H2O;NH4+;NO3-;
Ⅱ.A.浓硝酸不稳定,通常保存在棕色的试剂瓶中,故A正确;
B.足量铁与稀硝酸反应后溶液呈浅绿色,是由于铁与硝酸铁反应生成硝酸亚铁,故B错误;
C.不用浓硝酸与铜屑反应来制取硝酸铜,原因是浪费原料,产生污染,一般用氧化铜和稀硝酸反应,故C错误;
D.不用锌与稀硝酸反应制取氢气,原因是稀硝酸与锌反应生成NO气体,故D错误.
故选:A;
(1)设由NO2和纯碱反应产生CO2为amol,
由NO和NO2与纯碱反应产生的CO2为bmol,
2NO2+Na2CO3=NaNO2+NaNO3+CO2 质量增加
1mol△m=48g
amol 48ag
NO+NO2+Na2CO3=2NaNO2+CO2 质量增加
1mol△m=32g
bmol 32bg
解得
n(NO2)=
mol×2+
mol=
mol
n(NO)=
mol
x=
═1.83,
故答案为:1.83;
(2)若混合气体中V(NO):V(NO2)=3:1时,可设NO为3mol,NO2为1mol,为使气体被完全吸收,应满足NO为2mol,NO2为2mol,则需反应1molNO生成NO2,
由方程式2NO+O2=2NO2可知,需要0.5molO2,又空气中氧气的体积含量约为20%,则需要2.5mol空气,
所以V(空气):V(NO)=2.5:3=5:6,
故答案为:5:6.
(2)氨气在被氧化生成NO,为放热反应,反应的方程式为4NH3+5O2
| ||
| △ |
故答案为:反应为放热反应;4NH3+5O2
| ||
| △ |
Ⅱ.A.浓硝酸不稳定,通常保存在棕色的试剂瓶中,故A正确;
B.足量铁与稀硝酸反应后溶液呈浅绿色,是由于铁与硝酸铁反应生成硝酸亚铁,故B错误;
C.不用浓硝酸与铜屑反应来制取硝酸铜,原因是浪费原料,产生污染,一般用氧化铜和稀硝酸反应,故C错误;
D.不用锌与稀硝酸反应制取氢气,原因是稀硝酸与锌反应生成NO气体,故D错误.
故选:A;
(1)设由NO2和纯碱反应产生CO2为amol,
由NO和NO2与纯碱反应产生的CO2为bmol,
2NO2+Na2CO3=NaNO2+NaNO3+CO2 质量增加
1mol△m=48g
amol 48ag
NO+NO2+Na2CO3=2NaNO2+CO2 质量增加
1mol△m=32g
bmol 32bg
|
解得
|
n(NO2)=
| 1 |
| 6 |
| 1 |
| 12 |
| 5 |
| 12 |
n(NO)=
| 1 |
| 12 |
x=
| ||||
|
故答案为:1.83;
(2)若混合气体中V(NO):V(NO2)=3:1时,可设NO为3mol,NO2为1mol,为使气体被完全吸收,应满足NO为2mol,NO2为2mol,则需反应1molNO生成NO2,
由方程式2NO+O2=2NO2可知,需要0.5molO2,又空气中氧气的体积含量约为20%,则需要2.5mol空气,
所以V(空气):V(NO)=2.5:3=5:6,
故答案为:5:6.
点评:本题以氮氧化物为载体考查了物质间的反应,明确物质的性质是解本题关键,难点是Ⅱ题的计算,要结合方程式中各个物理量之间的关系式解答,会根据题给信息计算x值,难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
下列有关说法中错误的是( )
| A、随着原子序数的增大,同周期简单离子的半径依次减小 |
| B、元素周期表中原子半径最小和最大的元素在同一主族 |
| C、王水是浓硝酸和浓盐酸以体积比1:3混合的溶液 |
| D、1L 1mol?L的氨水中NH3、NH4+、NH3?H2O的物质的量之和为1mol |
已知:
(1)2Fe3++2I-═2Fe2++I2
(2)Br2+2Fe2+═2Fe3++2Br-
由此推断氧化剂的氧化性强弱顺序为( )
(1)2Fe3++2I-═2Fe2++I2
(2)Br2+2Fe2+═2Fe3++2Br-
由此推断氧化剂的氧化性强弱顺序为( )
| A、Br2>Fe3+>I2 |
| B、Fe3+>Br2>I2 |
| C、I2>Br2>Fe3+ |
| D、Br2>I2>Fe3+ |
下列离子方程式书写正确的是( )
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
| D、向NH4Al(SO4)2溶液中不断滴加Ba(OH)2至溶液中SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
下列图示的有关说法正确的是( )
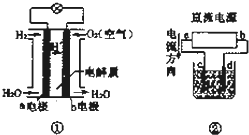

| A、装置①中负极反应式为H2+2e-═2H+ |
| B、装置①工作时,外电路电子由a电极流向b电极 |
| C、若采用装置②精炼铜,则d为粗铜,c为纯铜 |
| D、若装置②用惰性电极电解稀H2SO4溶液,则溶液pH升高 |
 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如图(砷原子为白色球).试回答下列问题
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如图(砷原子为白色球).试回答下列问题

