题目内容
在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)?4C(g),达平衡时c(A)=1.00
mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是( )
mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是( )
| A、系数x>2 | ||
| B、若增大该体系的压强,平衡向左移动,化学平衡常数变小 | ||
| C、若增大该体系的压强,平衡向右移动,化学平衡常数不变 | ||
D、该反应的化学平衡常数表达式是K=
|
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:依据气体压强之比等于气体物质的量之比,在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)?4C(g),达平衡时c(A)=1.00
mol?L-1,现将压强减小到1.01×105Pa,压强减少5倍,建立平衡后,A的浓度应减少原来的
,应为0.2mol/L,题干中平衡后c(A)=0.18mol?L-1,说明压强减小,平衡正向进行;
mol?L-1,现将压强减小到1.01×105Pa,压强减少5倍,建立平衡后,A的浓度应减少原来的
| 1 |
| 5 |
解答:
解:依据气体压强之比等于气体物质的量之比,在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)?4C(g),达平衡时c(A)=1.00
mol?L-1,现将压强减小到1.01×105Pa,压强减少5倍,建立平衡后,A的浓度应减少原来的
,应为0.2mol/L,题干中平衡后c(A)=0.18mol?L-1,说明压强减小,平衡正向进行;
A、上述分析判断减小压强平衡正向进行,说明正向反应是气体体积增大的反应,2+x<4,x<2,故A错误;
B、上述分析判断反应是气体体积增大的反应,增大压强,平衡逆向进行,平衡常数只随温度变化,不随浓度变化,故B错误;
C、反应是气体体积增大的反应,增大压强,平衡逆向进行,平衡常数只随温度变化,不随浓度变化,故C错误;
D、计算分析x=1,2A(g)+B(g)?4C(g),平衡常数K=
,故D正确;
故选D.
mol?L-1,现将压强减小到1.01×105Pa,压强减少5倍,建立平衡后,A的浓度应减少原来的
| 1 |
| 5 |
A、上述分析判断减小压强平衡正向进行,说明正向反应是气体体积增大的反应,2+x<4,x<2,故A错误;
B、上述分析判断反应是气体体积增大的反应,增大压强,平衡逆向进行,平衡常数只随温度变化,不随浓度变化,故B错误;
C、反应是气体体积增大的反应,增大压强,平衡逆向进行,平衡常数只随温度变化,不随浓度变化,故C错误;
D、计算分析x=1,2A(g)+B(g)?4C(g),平衡常数K=
| c4(C) |
| c2(A)?c(B) |
故选D.
点评:本题考查了化学平衡影响因素分析判断,平衡常数概念理解应用,注意平衡常数随温度变化,题目较简单.

练习册系列答案
相关题目
用下列实验装置进行的实验,能达到相应实验目的是( )
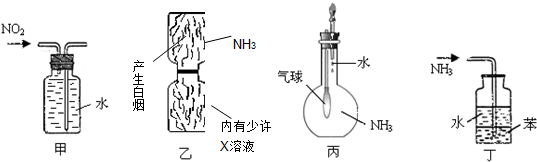

| A、装置甲:收集NO2气体 |
| B、装置乙:验证X溶液为浓硫酸 |
| C、装置丙:验证氨气在水中的溶解性 |
| D、装置丁:用于吸收尾气NH3 |
下列物质的分类合理的是( )
| A、氧化物:CO2、NO、SO2、H2O |
| B、碱:NaOH、KOH、Ba(OH)2、Na2CO3 |
| C、铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、碱性氧化物:Na2O、CaO、Mn2O7、Al2O3 |
已知3.2g某气体中含有3.01×1022个分子,此气体的摩尔质量是( )
| A、32g/mol | B、64 |
| C、64g/mol | D、4g |
在某BaCl2溶液中通入SO2气体,未见沉淀生成;若先通入SO2气体,再通入另一种气体,则可看到沉淀生成;这种气体不可能是( )
| A、Cl2 |
| B、NH3 |
| C、HCl |
| D、SO3(气体) |
已知:
(1)2Fe3++2I-═2Fe2++I2
(2)Br2+2Fe2+═2Fe3++2Br-
由此推断氧化剂的氧化性强弱顺序为( )
(1)2Fe3++2I-═2Fe2++I2
(2)Br2+2Fe2+═2Fe3++2Br-
由此推断氧化剂的氧化性强弱顺序为( )
| A、Br2>Fe3+>I2 |
| B、Fe3+>Br2>I2 |
| C、I2>Br2>Fe3+ |
| D、Br2>I2>Fe3+ |
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A、正丁烷 |
| B、异丁烷 |
| C、2-甲基丁烷 |
| D、2,2-二甲基丙烷 |
 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如图(砷原子为白色球).试回答下列问题
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如图(砷原子为白色球).试回答下列问题