题目内容
16.氯气是一种重要的工业原料.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O他们利用该反应设计如下制取氯气并验证其性质的实验.
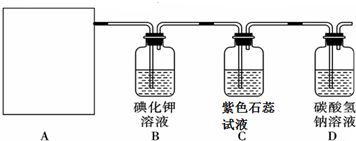
回答下列问题:
(1)每生成1mol Cl2,上述化学反应转移电子数目为NA.
(2)该实验中A部分的装置是乙 (填标号).
(3)装置B中发生反应的离子方程式Cl2+2I-=I2+2Cl-.
(4)装置C中的现象为溶液先变红后褪色.
(5)写出D装置中发生总反应的离子方程式Cl2+HCO3-=Cl-+HClO+CO2.
(6)该实验存在明显的缺陷,请你提出改进的方法应将尾气通入氢氧化钠溶液中.
分析 (1)发生Ca(ClO)2+CaCl2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O,氯元素化合价变化,生成2mol氯气转移2mol电子;
(2)依据反应物状态和反应条件选择合适发生装置;
(3)氯气的氧化性强于碘,能够氧化碘离子生成单质碘;
(4)氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性;
(5)氯气通入碳酸氢钠溶液,可以理解为氯气先于水反应生成盐酸和次氯酸,盐酸的酸性强于碳酸,能够与碳酸氢钠反应生成氯化钠、水和二氧化碳,次氯酸的酸性弱于碳酸,与碳酸氢钠不反应;
(6)氯气有毒,直接排放容易造成空气污染,氯气与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收过量氯气.
解答 解:(1)反应Ca(ClO)2+CaCl2+2H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+2Cl2↑+2H2O中,只有氯元素化合价变化,生成2mol氯气转移2mol电子,所以生成1mol Cl2,上述化学反应转移电子数目为1mol,个数为NA;
故答案为:NA;
(2)该反应的反应物的状态为固体和液体,反应条件是加热,应选择乙装置;
故答案为:乙;
(3)氯气与碘离子发生氧化还原反应生成单质碘和氯离子,离子方程式:Cl2+2I-=I2+2Cl-;
故答案为:Cl2+2I-=I2+2Cl-;
(4)氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,所以装置C中看到的现象为:溶液先变红后褪色;
故答案为:溶液先变红后褪色;
(5)氯气与碳酸氢钠溶液反应生成氯化钠、次氯酸和二氧化碳,离子方程式:Cl2+HCO3-=Cl-+HClO+CO2,故答案为:Cl2+HCO3-=Cl-+HClO+CO2;
(6)氯气有毒,直接排放容易造成空气污染,氯气与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收过量氯气,故答案为:应将尾气通入氢氧化钠溶液中.
点评 本题考查了氯气的制备原理和性质的检验,熟悉反应原理和氯气的性质是解题关键,题目难度不大.

| A. |  分离CCl4和水 | |
| B. |  洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. |  液体分层,下层呈无色 | |
| D. |  除去氯气中的氯化氢 |
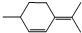
①取代反应 ②加成反应 ③消去反应 ④使溴的四氯化碳溶液褪色
⑤聚合反应 ⑥使酸性高锰酸钾溶液褪色.
| A. | 全部 | B. | 除⑤外 | C. | 除①外 | D. | 除①、⑤外 |
| A. | 标准状况下,40 g SO3所含的氧原子的数目为1.5 NA | |
| B. | 5.6 g铁与足量氯气或硫蒸气反应转移的电子数均为0.3 NA | |
| C. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| D. | 常温下5.6 g铁投入到足量浓硝酸中反应,转移电子数为0.3 NA |


 ;DB2有多种重要的用途,请你写出其中的一种:制玻璃、制光导纤维、制粗硅(其中一种).
;DB2有多种重要的用途,请你写出其中的一种:制玻璃、制光导纤维、制粗硅(其中一种).
 ,B中具有的官能团的名称酯基、溴原子.
,B中具有的官能团的名称酯基、溴原子.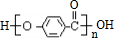 .
. .
. .
. ,
,