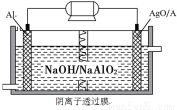
��Ŀ����
16��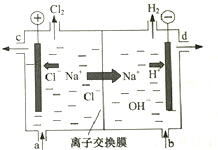 �ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
�ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ�������������գ�
��1��д����ⱥ��ʳ��ˮ�����ӷ���ʽ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2��
��2�����ӽ���Ĥ������Ϊ����ֹ�������ɵ��������������ɵ��������Ʒ�Ӧ��ʹ��Ʒ��������ֹ�������ɵ��������������ɵ�������Ӧ����Ӧ��������ȫ�¹ʣ�
��3�����Ʊ���ʳ��ˮ��ͼ��aλ�ò��䣬����������Һ��ͼ��dλ����������ѡ�a������b������c����d����
��4��KClO3���ԺͲ��ᣨH2C2O4�������ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʣ�
д���÷�Ӧ�Ļ�ѧ����ʽ2KClO3+H2C2O4+2H2SO4�T2ClO2��+2CO2��+2KHSO4+2H2O
��5�������£�0.1mol/L NaClO��Һ��pH����0.1mol/L Na2SO3��Һ��pH����ѡ����ڡ�����С�ڡ����ڡ���
Ũ�Ⱦ�Ϊ0.1mol/L��Na2SO3��Na2CO3�Ļ����Һ�У�SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊc��SO32-����c��CO32-��c��HCO3-����c��HSO3-����
��֪��H2SO3Ki1=1.54��10-2 Ki2=1.02��10-7
HClOKi1=2.95��10-8
H2CO3Ki1=4.3��10-7Ki2=5.6��10-11��
���� ��1����⾫�Ʊ���ʳ��ˮ�����������������ռ
��2�������ӽ���Ĥֻ��������ͨ���������Ӻ����岻��ͨ����
��3����ⱥ��ʳ��ʱ����������Cl-��OH-�ŵ磬Cl-�ķŵ�����ǿ��OH-�����������ķ���ʽΪ��2Cl--2e-�TCl2����������2H++2e-�TH2����H2��NaOH��������NaOH��Һ�ij���Ϊd��Cl2�����������Ʊ���ʳ��ˮ���������룻
��4��KClO3�Ͳ��ᣨH2C2O4�������������·�Ӧ����ClO2��CO2��KHSO4������������ԭ��Ӧ����������غ����д��ѧ����ʽ��
��5��H2SO3Ki1=1.54��10-2��Ki2=1.02��10-7��HClOKi1=2.95��10-8 ��˵��ClO-ˮ��̶ȴ���SO32-��
H2SO3Ki1=1.54��10-2 Ki2=1.02��10-7��H2CO3Ki1=4.3��10-7Ki2=5.6��10-11��˵��SO32-ˮ��̶�С��CO32-��
��� �⣺��1����⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ��Ӧ�����ӷ���ʽΪ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH-+H2��+Cl2����
��2�������ӽ���Ĥֻ��������ͨ���������Ӻ����岻��ͨ������ʯī���缫��ⱥ���Ȼ���ʱ�������������ӷŵ�������������������ͨ�������ӽ���Ĥ�����������������������������������ϲ�����ը����������������Һ��Ӧ�����Ȼ��ơ��������ƶ�������ȡ���������Ʋ�����
�ʴ�Ϊ����ֹ�������ɵ��������������ɵ��������Ʒ�Ӧ��ʹ��Ʒ��������ֹ�������ɵ��������������ɵ�������Ӧ����Ӧ��������ȫ�¹ʣ�
��3�������������������ӷŵ�����������ˮ����ƽ�������������������Ũ��������������������Һ��NaOH��Һ�ij���Ϊd��
Cl2������������װ��ͼ������֪���Ʊ���ʳ��ˮ���������룬������Ϊa��
�ʴ�Ϊ��a��d��
��4��KClO3�Ͳ��ᣨH2C2O4�������������·�Ӧ����ClO2��CO2��KHSO4����Ӧ�ķ���ʽΪ��2KClO3+H2C2O4+2H2SO4�T2ClO2��+2CO2��+2KHSO4+2H2O��
�ʴ�Ϊ��2KClO3+H2C2O4+2H2SO4�T2ClO2��+2CO2��+2KHSO4+2H2O��
��5��H2SO3 Ki1=1.54��10-2��Ki2=1.02��10-7��HClOKi1=2.95��10-8 ��˵��ClO-ˮ��̶ȴ���SO32-��0.1mol/L NaClO��Һ��pH����0.1mol/L Na2SO3��Һ��pH�����ݵ���ƽ�ⳣ����С�Ƚϣ�H2SO3Ki1=1.54��10-2 Ki2=1.02��10-7��H2CO3Ki1=4.3��10-7Ki2=5.6��10-11��˵��SO32-ˮ��̶�С��CO32-��Ũ�Ⱦ�Ϊ0.1mol/L��Na2SO3��Na2CO3�Ļ����Һ�У�SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊc��SO32-����c��CO32-��c��HCO3-����c��HSO3-����
�ʴ�Ϊ������c��SO32-����c��CO32-��c��HCO3-����c��HSO3-����
���� ���⿼���˵��ԭ���ķ������缫�����жϷ�������ѧ����ʽ��д����Ҫ��������ʵ���̶ȴ�С������ˮ���ԭ��Ӧ�ã�����Ũ�ȴ�С�Ƚϣ���Ŀ�Ѷ��еȣ�

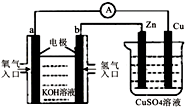
| A�� | һ��ʱ���Zn�缫���ܽ� | |
| B�� | ��װ����Cu��Ϊ������������ԭ��Ӧ | |
| C�� | b����Ӧ�ĵ缫��ӦʽΪ��H2-2e-=2H+ | |
| D�� | ��������a�缫�� ��Cu�缫 ��Cu�缫 |
| A�� | 2�� | B�� | 0.25mol | C�� | 3.01��1023�� | D�� | 1mol |
| �ɷ� | CaO | P2O5 | SO3 | CO2 |
| ����������%�� | 47.30 | 28.40 | 3.50 | 6.10 |
��2����ʯ�У���Ԫ�غ�̼Ԫ�ص����ʵ���֮����0.80��1��������λС����
��3����ʯ�У�CaSO4����������Ϊ5.95%��������λС����
��4��ȡ50.00g��ʯ��ĩ������������Ũ���ᣬ�����ȣ���Ԫ��ȫ����CaSO4����ʽ���ڣ����Եõ�CaSO457.12g��������λС����
| A�� | �������ᡢ�Ҵ� | B�� | �Ҵ�����ȩ������ | ||
| C�� | �������ᡢ���Ȼ�̼ | D�� | �����������Ȼ�̼���Ҵ� |
 ���������������� ��ʹ����KMnO4��Һ��ɫ���� ��ʹ������Ȼ�̼��Һ��ɫ���� ������ˮ���� �����ڱ��У��� ����Ũ���ᷢ��ȡ����Ӧ���� ���е�ԭ�ӿ��ܹ�ƽ�档������ȷ���ǣ� ��
���������������� ��ʹ����KMnO4��Һ��ɫ���� ��ʹ������Ȼ�̼��Һ��ɫ���� ������ˮ���� �����ڱ��У��� ����Ũ���ᷢ��ȡ����Ӧ���� ���е�ԭ�ӿ��ܹ�ƽ�档������ȷ���ǣ� ��