题目内容
某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示的装置进行有关的实验。
请回答:
(1)装置A中发生反应的化学方程式为_______________。
(2)装置D中试管中放置的棉花中应浸一种液体,这种液体是__________,其作用是__________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是__________。B中应放置的液体是__________(填选项序号)。
a.水 b.酸性KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,他们取
①有一定量的余酸但未能与铜片完全反应,你认为原因是__________。
②下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是__________(填选项序号)。
a.Fe粉 b.BaCl2溶液 c.Ag粉 d.NaHCO3溶液
(5)为定量测定余酸的物质的量浓度,某同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。而测定SO2的量的方法有多种,你认为下列实验方案中可行的是________(填选项序号)。
a.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置A产生的气体缓缓通入足量的用硫酸酸化的KMnO4溶液,再加入BaCl2溶液,过滤、洗涤、干燥、称量沉淀
c.用排水法测定装置A产生气体的体积(已折算成标准状况)
d.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)碱液(其他合理答案均可) 吸收多余的二氧化硫,防止污染空气
(3)广口瓶中液面下降,而长颈漏斗中液面上升 d
(4)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应 ②ad
(5)d
解析:(1)装置A中Cu与浓硫酸发生反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O.(2)装置D中品红用来检验SO2,由于SO2有毒,所以棉花中应浸有碱液(如NaOH等),防止污染环境.(3)当关闭K时,继续产生的SO2贮存在广口瓶中,所以广口瓶中液面下降,长颈漏斗中液面上升.B中液体不能与SO2发生反应,应选择饱和NaHSO3溶液.(4)①稀硫酸不与Cu反应.②欲证明烧瓶中有多余的H+,可以选择Fe粉或NaHCO3溶液.(5)a中有水蒸气干扰;b中引入了
CuSO4+SO2↑+2H2O.(2)装置D中品红用来检验SO2,由于SO2有毒,所以棉花中应浸有碱液(如NaOH等),防止污染环境.(3)当关闭K时,继续产生的SO2贮存在广口瓶中,所以广口瓶中液面下降,长颈漏斗中液面上升.B中液体不能与SO2发生反应,应选择饱和NaHSO3溶液.(4)①稀硫酸不与Cu反应.②欲证明烧瓶中有多余的H+,可以选择Fe粉或NaHCO3溶液.(5)a中有水蒸气干扰;b中引入了![]() ;c中SO2能够在水中溶解;d方案可行.
;c中SO2能够在水中溶解;d方案可行.

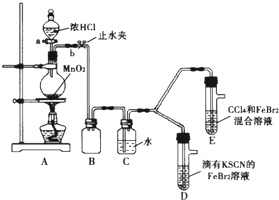 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:(1)①连接仪器:把玻璃导管插入橡胶塞的操作是:
②检查气体发生装置A的气密性的操作是:向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)整套实验装置存在一处明显不足,请指出
用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因
 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.

