题目内容
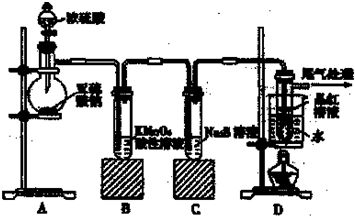
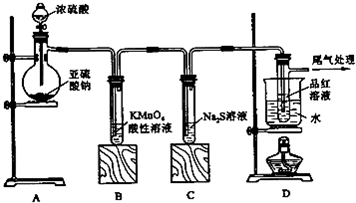
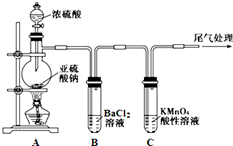 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.已知:Na2SO3+H2SO4(浓)
| ||
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是
(2)实验过程中,C中的现象是
(3)实验过程中,观察到装置B中出现了明显的白色沉淀.为探究该白色沉淀的成分,该小组同学进行了如下实验:
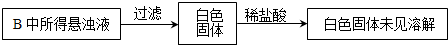
根据实验事实判断该白色沉淀的成分是
a.BaSO3既不溶于水也不溶于酸 b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并明理由
分析:(1)该仪器是分液漏斗;
(2)二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化;
(3)白色沉淀不溶解,说明该沉淀是硫酸钡,二氧化硫被氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(4)浓硝酸具有强氧化性,能将亚硫酸钠氧化生成硫酸钠而得不到二氧化硫.
(2)二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化;
(3)白色沉淀不溶解,说明该沉淀是硫酸钡,二氧化硫被氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(4)浓硝酸具有强氧化性,能将亚硫酸钠氧化生成硫酸钠而得不到二氧化硫.
解答:解:(1)该仪器名称是分液漏斗,故答案为:分液漏斗;
(2)二者反应生成锰离子和硫酸根离子而使高锰酸钾溶液褪色,通过该反应说明二氧化硫具有还原性,该反应说明二氧化硫具有还原性,故答案为:KMnO4溶液褪色;还原;
(3)硫酸钡不溶于酸和水,亚硫酸钡易溶于酸,该沉淀不溶于稀盐酸,说明沉淀是硫酸钡;
二氧化硫具有还原性,在水溶液里能被氧化剂氧化生成硫酸根离子,所以二氧化硫或氯化钡溶液中可能含有氧气将二氧化硫氧化为硫酸根离子,故选bd;
故答案为:BaSO4;bd;
(4)浓硫酸具有强氧化性,但不能氧化亚硫酸钠,浓硝酸具有强氧化性,能将亚硫酸钠氧化物硫酸钠而得不到二氧化硫,所以不能将浓硫酸换为浓硝酸,故答案为:有影响,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体.
(2)二者反应生成锰离子和硫酸根离子而使高锰酸钾溶液褪色,通过该反应说明二氧化硫具有还原性,该反应说明二氧化硫具有还原性,故答案为:KMnO4溶液褪色;还原;
(3)硫酸钡不溶于酸和水,亚硫酸钡易溶于酸,该沉淀不溶于稀盐酸,说明沉淀是硫酸钡;
二氧化硫具有还原性,在水溶液里能被氧化剂氧化生成硫酸根离子,所以二氧化硫或氯化钡溶液中可能含有氧气将二氧化硫氧化为硫酸根离子,故选bd;
故答案为:BaSO4;bd;
(4)浓硫酸具有强氧化性,但不能氧化亚硫酸钠,浓硝酸具有强氧化性,能将亚硫酸钠氧化物硫酸钠而得不到二氧化硫,所以不能将浓硫酸换为浓硝酸,故答案为:有影响,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体.
点评:本题考查了浓硫酸、浓硝酸、二氧化硫的性质,利用强酸制取弱酸来制取二氧化硫气体,知道二氧化硫的性质有哪些,注意:虽然浓硫酸具有强氧化性,因为反应时不能发生化合价交叉,所以浓硫酸不能和亚硫酸钠反应,为易错点.

练习册系列答案
相关题目
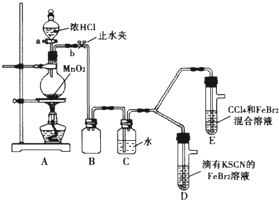 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:(1)①连接仪器:把玻璃导管插入橡胶塞的操作是:
②检查气体发生装置A的气密性的操作是:向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)整套实验装置存在一处明显不足,请指出
用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因
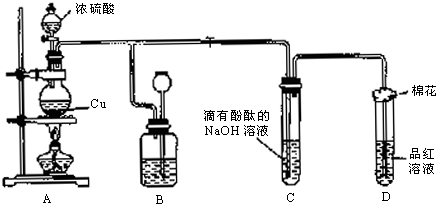 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.