题目内容
某化学兴趣小组为探究SO2的性质,按如图Ⅰ所示装置进行实验.

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是
(2)实验过程中,装置B、C中发生反应的现象分别是
(3)该实验小组的甲、乙两位同学利用上述图Ⅱ装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①请写出实验室制取氯气的化学方程式:
如何除去所制氯气中混有的氯化氢杂质:
②试分析甲同学实验过程中,品红溶液不褪色的原因是(用离子方程式表示):
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
分析:(1)根据仪器名称书写;亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫和水;
(2)二氧化硫能被酸性高锰酸钾氧化,能和硫化氢发生氧化还原反应生成硫单质;根据元素化合价变化判断氧化性、还原性;
(3)①加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气、氯化锰和水;
实验室用饱和食盐水除去氯气中的氯化氢;
②二氧化硫和氯气发生氧化还原反应生成盐酸和硫酸;
③如果二氧化硫和氯气不恰好反应,则品红溶液会慢慢褪色.
(2)二氧化硫能被酸性高锰酸钾氧化,能和硫化氢发生氧化还原反应生成硫单质;根据元素化合价变化判断氧化性、还原性;
(3)①加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气、氯化锰和水;
实验室用饱和食盐水除去氯气中的氯化氢;
②二氧化硫和氯气发生氧化还原反应生成盐酸和硫酸;
③如果二氧化硫和氯气不恰好反应,则品红溶液会慢慢褪色.
解答:解:(1)该仪器是蒸馏烧瓶,硫酸的酸性大于亚硫酸,根据强酸制取弱酸知,硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,反应方程式为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,
故答案为:蒸馏烧瓶;Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O;
(2)酸性高锰酸钾具有强氧化性,通入二氧化硫后溶液褪色,说明高锰酸钾将二氧化硫氧化,自身被还原,所以二氧化硫具有还原性,看到的现象是溶液由紫色变为无色;
硫化氢和二氧化硫反应生成硫单质,硫不易溶于水,所以看到无色溶液中出现淡黄色沉淀,二氧化硫得电子而作氧化剂,氧化剂具有氧化性,
故答案为:溶液由紫红色变为无色;无色溶液出现淡黄色浑浊;还原性和氧化性;
(3)①加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气、氯化锰和水,反应方程式为:MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O,浓盐酸具有挥发性,加热促进浓盐酸挥发,导致氯气中含有氯化氢,氯化氢极易溶于水,氯气也能溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以用饱和食盐水除去氯气中的氯化氢,
故答案为:MnO2+4HCl (浓)
MnCl2+Cl2↑+2H2O;将混合气体通过盛有饱和食盐水的洗气瓶洗气;
②氯气具有强氧化性,二氧化硫具有还原性,在水溶液二者发生氧化还原反应生成硫酸和盐酸,硫酸和盐酸都没有漂白性,所以如果二者恰好反应,则溶液不褪色,发生的离子反应方程式为:SO2+Cl2+H2O=4H++SO42-+2Cl-,故答案为:SO2+Cl2+H2O=4H++SO42-+2Cl-;
③次氯酸和二氧化硫都能使品红溶液褪色,如果氯气或二氧化硫过量,则溶液会慢慢褪色,所以要使品红溶液褪色,则应该控制SO2和Cl2进气的物质的量,使之不相等,
故答案为:控制SO2和Cl2进气的物质的量,使之不相等.
故答案为:蒸馏烧瓶;Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O;
(2)酸性高锰酸钾具有强氧化性,通入二氧化硫后溶液褪色,说明高锰酸钾将二氧化硫氧化,自身被还原,所以二氧化硫具有还原性,看到的现象是溶液由紫色变为无色;
硫化氢和二氧化硫反应生成硫单质,硫不易溶于水,所以看到无色溶液中出现淡黄色沉淀,二氧化硫得电子而作氧化剂,氧化剂具有氧化性,
故答案为:溶液由紫红色变为无色;无色溶液出现淡黄色浑浊;还原性和氧化性;
(3)①加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成氯气、氯化锰和水,反应方程式为:MnO2+4HCl (浓)
| ||
故答案为:MnO2+4HCl (浓)
| ||
②氯气具有强氧化性,二氧化硫具有还原性,在水溶液二者发生氧化还原反应生成硫酸和盐酸,硫酸和盐酸都没有漂白性,所以如果二者恰好反应,则溶液不褪色,发生的离子反应方程式为:SO2+Cl2+H2O=4H++SO42-+2Cl-,故答案为:SO2+Cl2+H2O=4H++SO42-+2Cl-;
③次氯酸和二氧化硫都能使品红溶液褪色,如果氯气或二氧化硫过量,则溶液会慢慢褪色,所以要使品红溶液褪色,则应该控制SO2和Cl2进气的物质的量,使之不相等,
故答案为:控制SO2和Cl2进气的物质的量,使之不相等.
点评:本题考查了二氧化硫、氯气的实验室制法、性质等知识点,明确实验原理是解本题关键,再结合物质间的反应来分析解答,注意:次氯酸和二氧化硫都具有漂白性,但氯气和二氧化硫的混合物可能没有漂白性,知道二氧化硫和次氯酸漂白原理的差别,二氧化硫不能使酸碱指示剂褪色,为易错点.

练习册系列答案
相关题目
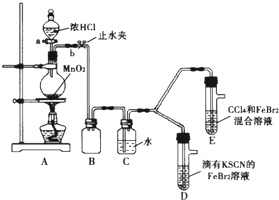 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:(1)①连接仪器:把玻璃导管插入橡胶塞的操作是:
②检查气体发生装置A的气密性的操作是:向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)整套实验装置存在一处明显不足,请指出
用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因
 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.