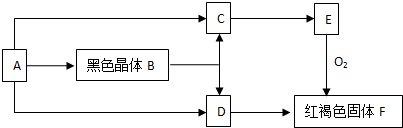
题目内容
16.在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中被氧化的元素( )| A. | K | B. | H | C. | Mn | D. | Cl |
分析 反应中Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,以此解答该题.
解答 解:反应中锰元素化合价从+7 价降低到+2价,所以氧化剂为KMnO4;氯元素化合价从-1价升高为0价,所以被氧化的元素为Cl,
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念以及物质具有的性质,难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
1.两气体A和B的摩尔质量之比为3:1,则它们在同温、同压、同体积时的分子个数比应为( )
| A. | 1:1 | B. | 1:3 | C. | 3:1 | D. | 9:1 |
5.下列叙述正确的是( )
| A. | 阿伏加德罗常数就是6.02×1023 | |
| B. | 物质的量是一物理量,表示含有一定数目粒子的集体 | |
| C. | 摩尔是七个基本物理量之一 | |
| D. | 摩尔既是物质的量的单位,又是粒子的数量单位 |
6.NH3和NO2在催化剂作用下反应:8NH3+6NO2═7N2+12H2O.若还原产物比氧化产物少0.1mol,则下列判断正确的是( )
| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |
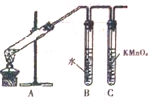 为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如图所示.回答:
为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如图所示.回答: