题目内容
【题目】X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有18个电子,相关信息如下表所示(“/”表示相应的信息略去):
化合物 | X | Y | Z |
分子中含有的原子个数 | / | 4 | / |
摩尔质量/g·mol-1 | 32 | 34 | / |
回答下列问题:
(1)X常用作火箭推进剂,其分子的球棍模型为![]() 则X的化学式为________。
则X的化学式为________。
(2)Y的化学性质描述正确的是________。
a.不稳定性 b.弱碱性
c.氧化性 d.还原性
(3)Z的化学式可用H2A表示。将一定量的Z气体通入0.05 mol·L-1CuSO4溶液中,二者恰好完全反应。已知Ksp(CuA)=6.0×10-36。若不考虑溶液体积的变化,则:
①反应后溶液的pH=________。
②若反应后溶液中c(A2-)=2.0×10-30mol·L-1,则溶液中c(Cu2+)=________mol·L-1。
(4)将一定量的Z气体通入NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
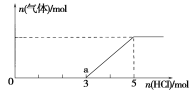
①0点溶液中所含溶质的化学式为____________。
②已知a点溶液呈碱性,该溶液中离子浓度大小顺序为______________________。
【答案】(1)N2H4 (2)acd (3)①1 ②3.0×10-6
(4)①Na2S和NaOH ②c(Na+)>c(Cl-)>c(HS-)>c(OH-)>c(H+)>c(S2-)
【解析】根据题目信息可知X为N2H4,Y为H2O2,Z为H2S。(2)Y为H2O2,其具有不稳定性、氧化性、还原性。(3)Z为H2S,将一定量的H2S气体通入0.05 mol·L-1CuSO4溶液中,二者恰好完全反应生成硫化铜沉淀和硫酸。①反应后溶液中氢离子浓度为0.1 mol·L-1,pH=1;②若反应后溶液中c(S2-)=2.0×10-30mol·L-1,根据Ksp(CuS)=c(Cu2+)·c(S2-)=6.0×10-36计算,则溶液中c(Cu2+)=3.0×10-6mol·L-1。(4)根据题给图像结合反应Na2S+HCl===NaHS+NaCl,NaHS+HCl===NaCl+H2S↑分析可知,①0点溶液中所含溶质的化学式为Na2S和NaOH;②由图像可知,a点溶液为NaCl和NaHS的混合液且氯化钠的浓度大于硫氢化钠的浓度;溶液呈碱性,说明硫氢根离子的水解程度大于电离程度,故该溶液中离子的物质的量浓度由大到小的顺序是c(Na+)>c(Cl-)>c(HS-)>c(OH-)>c(H+)>c(S2-)


