题目内容
【题目】草酸钴是制备高品质钴氧化物和单质钴粉的重要中间产品。用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)可以制备草酸钴晶体(CoC2O4·2H2O)。一种制备方法是选择草酸做沉淀剂,工业流程如图。
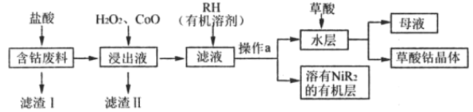
己知:①相关金属离子以氢氧化物形式沉淀完全的pH如下:
金属离子 | Fe3+ | Al3+ | Co2+ | Fe2+ | Ni2+ |
沉淀完全的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.5 |
②CoC2O4+2C2O![]()
![]() [Co(C2O4)3]4-。
[Co(C2O4)3]4-。
回答下列问题:
(1)CoC2O4中Co的化合价是___。
(2)浸出液中含有的阳离子除了H+、Co2+外,还有___。
(3)滤渣II的主要成分有___(填化学式)。
(4)加入RH的目的是___,操作a的名称是___。
(5)用一定浓度的草酸沉淀Co2+时,lg[Co]T,随溶液pH变化如图所示([Co]T表示Co以非沉淀形式存在的各种形态浓度之和)。
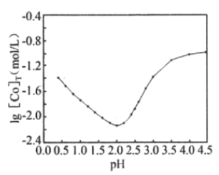
①沉淀Co2+时,应控制pH在___。
②lg[Co]T随pH的增大先减小后增大的原因为___。
(6)母液经氯气氧化后溶液中的盐酸可以循环使用,写出母液与氯气反应的化学方程式___。
【答案】+2 Fe2+、Ni2+、Al3+ Fe(OH)3、Al(OH)3 萃取Ni2+、与Co2+分离 分液 2.0 随pH增大,c(C2O![]() )增大,Co2+更多以CoC2O4形式存在,lg[Co2+]T减小,随着pH的继续增大,c(C2O
)增大,Co2+更多以CoC2O4形式存在,lg[Co2+]T减小,随着pH的继续增大,c(C2O![]() )增大,促进CoC2O
)增大,促进CoC2O![]() +2C2O
+2C2O![]()
![]() [Co(C4O4)3]4-正向进行,lg[Co2+]T增大 Cl2+H2C2O4=2CO2+2HCl
[Co(C4O4)3]4-正向进行,lg[Co2+]T增大 Cl2+H2C2O4=2CO2+2HCl
【解析】
含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)加入盐酸后,Co 、Ni、Al2O3、Fe与盐酸反应生成Co2+、Ni2+、Fe2+、Al3+,SiO2不与盐酸反应故滤渣I为SiO2;向浸出液中加入过氧化氢和氧化钴,氧化亚铁离子并调节pH,使Fe(OH)3、Al(OH)3以沉淀形式析出;再加入RH,生成溶于有机物的NiR2,分液后再加入草酸经操作生成草酸钴晶体。
(1)草酸根离子为-2价,故CoC2O4中Co的化合价为+2价;
(2)综上分析,浸出液中含有的阳离子除了H+、Co2+外,还有反应生成的、Ni2+、Fe2+、Al3+;
(3)因亚铁离子完全沉淀的pH大于钴离子,为防止钴离子的损失,加入过氧化氢氧化亚铁离子,使亚铁离子转化为铁离子,再加入氧化钴,调节pH,使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀而除去;
(4)滤液中含有Co2+、Ni2+,为了除去镍离子得到纯净的钴离子,故加入RH生成溶于有机物的NiR2而使Ni2+与Co2+分离;操作a将有机相和水相分离,操作名称为分液;
(5) ①根据图像可知,为了尽可能生成草酸钴沉淀,则o以非沉淀形式存在的各种形态浓度之和应尽可能得小,故pH应控制在2.0;
②用一定浓度的草酸沉淀Co2+,随pH增大,c(C2O![]() )增大,Co2+更多以CoC2O4形式存在,lg[Co2+]T减小,随着pH的继续增大,c(C2O
)增大,Co2+更多以CoC2O4形式存在,lg[Co2+]T减小,随着pH的继续增大,c(C2O![]() )增大,促进CoC2O
)增大,促进CoC2O![]() +2C2O
+2C2O![]()
![]() [Co(C4O4)3]4-正向进行,lg[Co2+]T增大;
[Co(C4O4)3]4-正向进行,lg[Co2+]T增大;
(6)母液中主要成分为草酸,草酸与氯气发生氧化还原反应生成二氧化碳和氯化氢,反应方程式为Cl2+H2C2O4=2CO2+2HCl。

【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将稀硝酸加入过量铁粉中,充分反应后滴加 | 有气体生成,溶液呈血红色 | 稀硝酸将 |
B | 将铜粉加 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
C |
| 溶液变红 |
质 |
D | 取少量绿矾 | 溶液未变红色 | 绿矾未因氧化而变质 |
A.AB.BC.CD.D