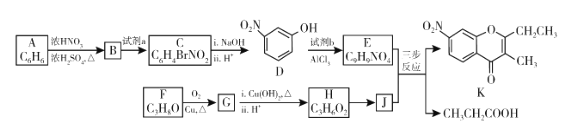
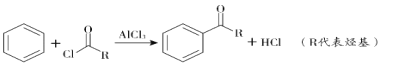
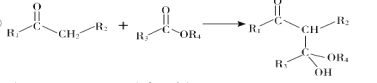
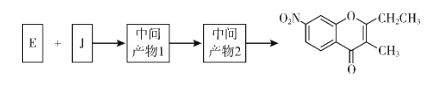
题目内容
【题目】氢氧化锂(LiOH)是重要的初加T锂产品之一,可用于继续生产氟化锂、锰酸锂等,用天然锂辉石(主要成分LiAISi2O3,含有Fe (III)等杂质)生产LiOH的一种工艺流程如图所示:
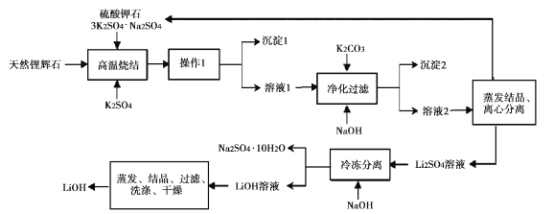
已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO42-等离子,请回答相关问题。
(l)将LiAlSi2O6改写为氧化物的形式:____。
(2)高温烧结的目的是____。操作1是 __ 。
(3)净化过滤过程中溶液的pH不能过低也不能过高,原因是____。
(4)流程中的某种物质可循环利用,该物质的化学式是____。
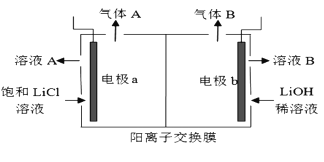
(5)工业生产中通过电解LiCI溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的____(选填“正极”或“负极”),电极b发生的反应是 ___,阳离子交换膜的作用是___
【答案】Li2OAl2O34SiO2 将锂辉石转化为可溶性硫酸盐,与杂质分离 溶解、过滤 pH过低Al3+和Fe3+不能完全除去,pH过高会使生成的Al(OH)3部分溶解 3K2SO4Na2SO4 正极 2H2O+2e-=H2↑+2OH- 可以防止OH-进入左室与Cl2反应,还可以让更多的Li+进入右室得到高浓度的LiOH
【解析】
(1)将硅酸盐改为氧化物形式的方法为;依次将各元素写成氧化物形式,中间用“”连接,同时注意氧化物的先后顺序,LiAlSi2O6改写为氧化物的形式为:Li2OAl2O34SiO2。
答案为:Li2OAl2O34SiO2。
(2)由操作1前后物质的状态可知,操作1应该是溶解、过滤,根据所得溶液1里的成分全部为可溶性硫酸盐电离产生的离子可以确定,高温烧结的目的一个是为了除去杂质,另外更重要的就是将矿石中难溶成分转化为可溶成分,再通过后续操作进行分离。
答案为:将锂辉石转化为可溶性硫酸盐,与杂质分离;溶解、过滤。
(3)净化操作中加入NaOH溶液,目的是为了将溶液里的杂质离子Fe3+、Al3+转化为沉淀除去,pH过低杂质不能完全除去,而pH过高,NaOH浓度太大,又能使生成的Al(OH)3部分溶解,所以需要控制溶液的pH在一定的范围。
答案为:pH过低Al3+和Fe3+不能完全除去,pH过高会使生成的Al(OH)3部分溶解。
(4)根据题词信息可知,可以循环使用的物质是:3K2SO4Na2SO4。
答案为:3K2SO4Na2SO4。
(5)据图可知电解池两极均有气体产生,则两极反应为:阳极:2Cl--2e-=Cl2↑,阴极:2H2O+2e-=H2↑+2OH-,由右室通入LiOH稀溶液可知,溶液B为制得的LiOH溶液,右室为阴极区,电极b与电源负极相连,则左室为阳极区,电极a与电源正极相连,电极b上的反应为:2H2O+2e-=H2↑+2OH-;阳离子交换膜可以防止OH-进入左室与Cl2反应,还可以让更多的Li+进入右室得到高浓度的LiOH。
答案为:正极;2H2O+2e-=H2↑+2OH-;可以防止OH-进入左室与Cl2反应,还可以让更多的Li+进入右室得到高浓度的LiOH。

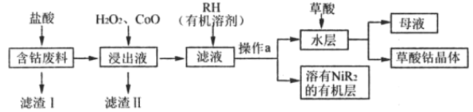
【题目】草酸钴是制备高品质钴氧化物和单质钴粉的重要中间产品。用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)可以制备草酸钴晶体(CoC2O4·2H2O)。一种制备方法是选择草酸做沉淀剂,工业流程如图。
己知:①相关金属离子以氢氧化物形式沉淀完全的pH如下:
金属离子 | Fe3+ | Al3+ | Co2+ | Fe2+ | Ni2+ |
沉淀完全的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.5 |
②CoC2O4+2C2O![]()
![]() [Co(C2O4)3]4-。
[Co(C2O4)3]4-。
回答下列问题:
(1)CoC2O4中Co的化合价是___。
(2)浸出液中含有的阳离子除了H+、Co2+外,还有___。
(3)滤渣II的主要成分有___(填化学式)。
(4)加入RH的目的是___,操作a的名称是___。
(5)用一定浓度的草酸沉淀Co2+时,lg[Co]T,随溶液pH变化如图所示([Co]T表示Co以非沉淀形式存在的各种形态浓度之和)。
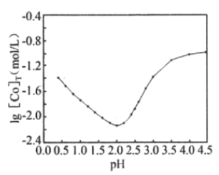
①沉淀Co2+时,应控制pH在___。
②lg[Co]T随pH的增大先减小后增大的原因为___。
(6)母液经氯气氧化后溶液中的盐酸可以循环使用,写出母液与氯气反应的化学方程式___。
【题目】2020年5月1日北京市在全市范围内开展施行垃圾分类,下列垃圾分类不正确是( )
A.鱼骨、菜叶 | B.消毒剂及其包装物 | C.破损的易拉罐 | D.破碎玻璃 |
|
|
|
|
厨余垃圾 | 有害垃圾 | 可回收垃圾 | 其他垃圾 |
A.AB.BC.CD.D