题目内容
17. 已知甲、乙、丙、丁、戊是中学化学中常见的物质,常温下,戊是一种无色无味的液体,它们之间有如下反应关系.
已知甲、乙、丙、丁、戊是中学化学中常见的物质,常温下,戊是一种无色无味的液体,它们之间有如下反应关系.(1)若甲是一种黑色晶体,且具有磁性.乙是一种常见的挥发性酸,丁为无色气体,则反应的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
(2)若甲是一种紫红色单质,乙是一种常见的难挥发性酸,反应时生成的丁是无色气体,反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,将过量丁气体通入到石蕊溶液中,将看到的现象为:溶液变红
(3)若实验室中利用固体甲和固体乙的反应制备气体丙,丙是一种无色、刺激性气味、密度比空气小的气体,则甲、乙为:NH4Cl、Ca(OH)2(填化学式),实验室通常如何证明有丙生成:湿润的红色石蕊试纸.
(4)若甲为常见有色气体单质,乙为强碱,该反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O已知丙由三种元素组成,其电子式
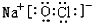 .
.
分析 甲、乙、丙、丁、戊是中学化学中常见的物质,常温下,戊是一种无色无味的液体,考虑戊为H2O.
(1)若甲是一种黑色晶体,且具有磁性,则甲为Fe3O4,乙是一种常见的挥发性酸,丁为无色气体,乙为HNO3,丁为NO,丙为Fe(NO3)3;
(2)若甲是一种紫红色单质,则甲为Cu,乙是一种常见的难挥发性酸,反应时生成的丁是无色气体,乙为硫酸,丁为二氧化硫;
(3)若实验室中利用固体甲和固体乙的反应制备气体丙,丙是一种无色、刺激性气味、密度比空气小的气体,应是实验室用氯化铵、氢氧化钙制备氨气的反应,可以利用氨气使湿润的红色石蕊试纸变蓝检验氨气;
(4)若甲为常见有色气体单质,乙为强碱,甲为氯气,乙为NaOH,反应生成氯化钠、次氯酸与水,丙由三种元素组成,则丙为NaClO.
解答 解:甲、乙、丙、丁、戊是中学化学中常见的物质,常温下,戊是一种无色无味的液体,考虑戊为H2O.
(1)若甲是一种黑色晶体,且具有磁性,则甲为Fe3O4,乙是一种常见的挥发性酸,丁为无色气体,乙为HNO3,丁为NO,丙为Fe(NO3)3,反应离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(2)若甲是一种紫红色单质,则甲为Cu,乙是一种常见的难挥发性酸,反应时生成的丁是无色气体,乙为硫酸,丁为二氧化硫,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,二氧化硫通入到石蕊溶液中,溶液变红,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;溶液变红;
(3)若实验室中利用固体甲和固体乙的反应制备气体丙,丙是一种无色、刺激性气味、密度比空气小的气体,应是实验室用氯化铵、氢氧化钙制备氨气的反应,可以利用氨气使湿润的红色石蕊试纸变蓝检验氨气,
故答案为:NH4Cl、Ca(OH)2;湿润的红色石蕊试纸;
(4)若甲为常见有色气体单质,乙为强碱,甲为氯气,乙为NaOH,反应生成氯化钠、次氯酸与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,丙由三种元素组成,则丙为NaClO,电子式为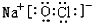 ,
,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;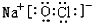 .
.
点评 本题考查无机物推断,注意根据物质的性质进行推断,需要学生熟练掌握元素化合物性质与转化,难度中等.

| A. | Wn+、Xm+、Ym-、Zn-的离子半径依次增大 | |
| B. | Y、Z的气态氢化物的热稳定性:HmY>HnZ | |
| C. | W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 | |
| D. | W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
| A. | AlCl3 | B. | Na2SO3 | C. | KMnO4 | D. | MgSO4 |
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | 高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害 | |
| C. | 光导纤维中所用材料为晶体硅 | |
| D. | NOx、SO2、CO2、PM2.5颗粒都会导致酸雨 |
| A. | 在元素周期表中,每一列就是一个族 | |
| B. | 主族元素都是短周期元素 | |
| C. | 副族元素都是金属元素 | |
| D. | 元素周期表每个长周期包含32种元素 |
| A. | Al | B. | Cl | C. | Mg | D. | Si |
| A. |  将NO2球浸泡在冷水中和热水中 | |
| B. | 排饱和食盐水收集氯气 | |
| C. | 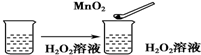 | |
| D. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3△H<0工业合成氨,通常选择高压的条件 |
| A. | 离子的氧化性:Na+>Mg2+>Al3+ | B. | 原子半径:Al>Mg>Na | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 单质的还原性:Na<Mg<Al |
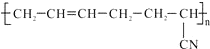 ,其具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
,其具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )