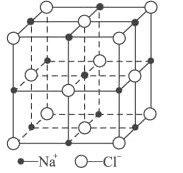
题目内容
【题目】下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是( )
A. K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
B. 比较Ksp与离子积Qc的相对大小,可判断难溶解电解质在给定条件下沉淀能否生成或溶解
C. K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
D. 弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka·Kh
【答案】A
【解析】温度升高平衡常数增大的应该是吸热反应,因为不知道反应的热效应,所以无法得到温度越高,K值越大的结论,选项A错误。可以利用Ksp与离子积Qc的相对大小,判断沉淀溶解平衡移动的方向,选项B正确。K值大小代表反应进行的程度,K值越大,正反应进行的程度越大,当K>105时,认为反应为不可逆反应,选项C正确。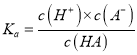 ,
, 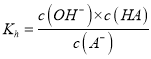 ,所以
,所以![]() ,选项D正确。
,选项D正确。

练习册系列答案
相关题目