题目内容
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
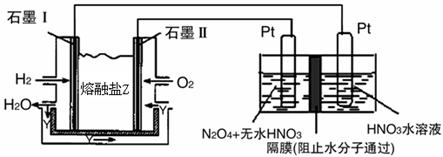
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)
 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
(1)极性(2分)
(2)60%(2分) CF(2分,全对得2分,只选1个且正确的得1分,选错1个扣1分)
(3)(b-a-4c)/2(3分)
(4)CH3OH-6e-+8OH-=CO32-+6H2O(3分) 3.2g(3分,数值正确、未写单位的扣1分)
(2)60%(2分) CF(2分,全对得2分,只选1个且正确的得1分,选错1个扣1分)
(3)(b-a-4c)/2(3分)
(4)CH3OH-6e-+8OH-=CO32-+6H2O(3分) 3.2g(3分,数值正确、未写单位的扣1分)
试题分析:(1)甲醇分子中的化学键都是极性键,且甲醇分子结构不对称,故甲醇是极性分子;(2)①根据化学平衡三行式计算,设消耗的一氧化碳物质的量为x;
CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol)1-x 2-2x x
1-x+2-2x+x=3×3/5x=0.6
一氧化碳转化率=60%;②A、2v(H2)=v(CH3OH),没有明确是正、逆反应速率 ,且速率之比不等于化学计量数之比,不能作为平衡标志,错误;B、CO的消耗速率等于CH3OH的生成速率,均为正反应速率,不能作为平衡标志,错误;C、随着反应的进行,容器内气体的物质的量不断改变,容器内的压强不断改变,若容器内的压强保持不变,说明反应达到平衡状态,正确;D、根据质量守恒定律知,容器内气体质量不变,体积固定,混合气体的密度保持不变,不能说明反应达到平衡状态,错误;E、反应混合气中各组分均为无色气体,混合气体的颜色保持不变,不能说明反应达到平衡状态,错误;F、根据质量守恒定律知,随着反应的进行,容器内气体质量不变,物质的量变化,混合气体的平均相对分子质量不断变化,若混合气体的平均相对分子质量不随时间而变化,说明反应达到平衡状态,正确;选CF;(3)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H═-akJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H═-bkJ?mol-1
③H2O(g)═H2O(l)△H═-ckJ?mol-1
依据盖斯定律计算,①/2—②/2+③×2得到热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H═(b-a-4c)/2 kJ·mol﹣1;(4)①由甲醇、氧气和NaOH溶液构成的燃料电池,通入甲醇的一极发生氧化反应生成碳酸根和水,作原电池的负极,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;②根据题意知,阳极电极反应为:2Cl --2e-=Cl2↑,4OH--4e-=2H2O+O2↑, 阴极电极反应为:Cu2++2e-=Cu, 2H++2e-=H2↑;阳极氯气和阴极氢气相同,设阳极生成的氧气物质的量为x,阴极上也应生成氢气物质的量x,根据电子守恒将题给数据代入列式:0.4+4x=0.2+0.4+2x,解得x=0.1mol,阳极上收集到氧气的物质的量0.1mol,质量为3.2g。

练习册系列答案
相关题目
 CO2(g)+4H2(g)
CO2(g)+4H2(g)
 H2(g)+
H2(g)+  2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表: 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
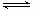 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据