题目内容
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如下
| | 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中溶解性 |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
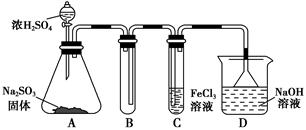
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。分离提纯:
③待A中液体冷却后将其缓慢倒人盛有70 mL水的分液谝斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为 。
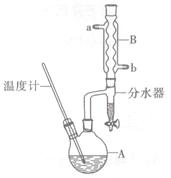
(2)加热A前,需先从____(填“a”或“b”)口向B中通入水。
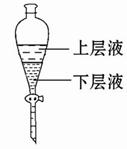
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应从分液漏斗的 (填“上”或“下”)口分离出。
(4)步骤③中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为____,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 。
(1)先加入正丁醇,再加入浓硫酸。
(2)b
(3)浓硫酸;上
(4)洗去有机层中残留的NaOH及中和反应生成的盐。
(5)D
(6)正丁醇;水
(7)34%
解析试题分析:(1)步骤①中浓硫酸和正丁醇的添加顺序为先向其中加入密度小的正丁醇,然后再加入密度大的浓硫酸。类似浓硫酸的稀释。(2)水冷凝器的冷却水加入方式是下口进入冷水,热水从上口流出。选项为b.(3)在反应混合物中,浓硫酸能溶解于水中,正丁醚不溶,正丁醇微溶于水。所以步骤③的目的是初步洗去浓硫酸。由于正丁醚、正丁醇密度都比水小,所以粗产物应从分液漏斗的上口分离出来。(4)步骤③中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐。(5)本实验的目的是为了制取正丁醚,而正丁醚的沸点为142℃.所以步骤⑤中,加热蒸馏时应收集142℃时的馏分。选项为d。(6)液体混合物加热会蒸出,经过冷凝器降温会转化为液体,由于正丁醇的密度不水小。又微溶于水,所以在上层,水在下层。因此分水器中上层液体的主要成分为正丁醇;下层液体的主要成分为水。(7)n(正丁醇)=37g÷74g/mol=0.5mol .根据方程式中正丁醇与正丁醚的相互关系可知:正丁醚的理论产物质的量为n(正丁醚)= 0.25mol. m(正丁醚)= 0.25mol×130g/mol=32.5g实际产的正丁醚的物质的量为:m(正丁醚)=" 11" g。所以本实验中,正丁醚的产率为(11g÷32.5g)×100%=34%。
考点:考查化学实验基本操作、混合物的分离方法、物质的产率的计算的知识。

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案实验室制取乙酸丁酯的实验装置有如下图所示两种装置供选用。其有关物质的物理性质如下表: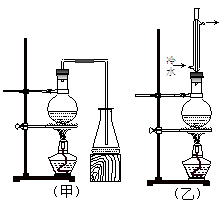
| | 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用 (填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是 (选填答案编号)。
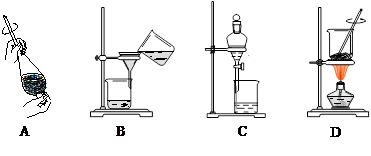
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂;烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20%KSCN、0.1 mol·L-1 NaOH、6 mol·L-1 NaOH、0.1 mol·L-1 HCl、蒸馏水。
必要时可参考:
| 沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
| Mg(OH)2 | 9.6 | 11.1 |
| Fe(OH)3 | 2.7 | 3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| …… | |
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是 。然后使用 (填写操作名称)分离并洗涤铁屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是 。
| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000 mol·L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL。
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式 。
②判断到达滴定终点的现象是 。
③该产品的纯度为 ﹪(保留四位有效数字)。
环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下: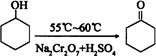
环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm—3、20 ℃) | 溶解性 | |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 | |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 | |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
A.蒸馏、除去乙醚后,收集151℃~156℃馏分
B.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
C.过滤
D.往液体中加入NaCl固体至饱和,静置,分液
E.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是 。
(2)b中水层用乙醚萃取的目的是 。
(3)从下关于萃取分液操作的叙述中,不正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡

B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作D中,加入NaCl固体的作用是 。蒸馏除乙醚的操作中采用的加热方式为 。
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是 。
 2KCl+3O2↑
2KCl+3O2↑