题目内容
某温度下,纯水的[H+]=2.0×10-7mol?L-1.在此温度下,某溶液中由水电离出的[H+]为4.0×10-13mol?L-1,则该溶液的pH可能是: .(lg4≈0.6)
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:先根据该温度下纯水电离的氢离子浓度计算出水的离子积;
酸或碱抑制水电离,含有弱根离子的盐促进水电离,当由水电离出的c(H+)水=4.0×10-13mol/L<2.0×10-7mol?L-1,则该溶液可能是酸也可能是碱,据此分别计算出酸溶液、碱溶液中氢离子浓度,再计算出溶液的pH.
酸或碱抑制水电离,含有弱根离子的盐促进水电离,当由水电离出的c(H+)水=4.0×10-13mol/L<2.0×10-7mol?L-1,则该溶液可能是酸也可能是碱,据此分别计算出酸溶液、碱溶液中氢离子浓度,再计算出溶液的pH.
解答:
解:该温度下水的离子积为:KW=c(H+)×c(OH-)=2.0×10-7×2.0×10-7=4×10-14,
酸或碱溶液会抑制水电离,当由水电离出的c(H+)水=1.0×10-13mol/L<2.0×10-7mol?L-1,说明溶质抑制了水的电离,该溶液可能是酸溶液,也可能是碱溶液;
若是酸溶液,溶液中氢氧根离子是水电离的,则溶液中氢氧根离子浓度为:c(OH-)=
mol/L=0.1mol/L,溶液的pH=1;
若是碱溶液,则溶液中氢离子浓度为水电离的,则该碱溶液的pH=-lg4.0×10-13=13-lg4≈13-0.6=12,4,
故答案为:1或12.4.
酸或碱溶液会抑制水电离,当由水电离出的c(H+)水=1.0×10-13mol/L<2.0×10-7mol?L-1,说明溶质抑制了水的电离,该溶液可能是酸溶液,也可能是碱溶液;
若是酸溶液,溶液中氢氧根离子是水电离的,则溶液中氢氧根离子浓度为:c(OH-)=
| 4×10-14 |
| 4×10-13 |
若是碱溶液,则溶液中氢离子浓度为水电离的,则该碱溶液的pH=-lg4.0×10-13=13-lg4≈13-0.6=12,4,
故答案为:1或12.4.
点评:本题考查了水的电离及其影响因素、溶液中pH的计算,题目难度中等,注意掌握溶液pH的计算方法,明确酸溶液、碱溶液抑制了水的电离,酸溶液中的氢氧根离子、碱溶液中的氢离子是水电离的.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
室温下,下列溶液中c(H+)最小的是( )
| A、c(OH-)=1×10-11mol?L-1 |
| B、pH=3的CH3COOH溶液 |
| C、pH=4的H2SO4溶液 |
| D、c(H+)=1×10-3mol?L-1 |
 磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线: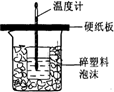 中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: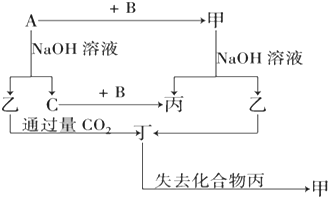 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.