题目内容
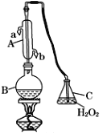
【题目】为了检验淀粉的水解产物,某学生设计了如下实验方案:
![]()
请回答下列问题
(1)试剂1为20%的H2SO4溶液,其作用是___________________;
(2)试剂2为_____,其作用是____________;
(3)反应①的化学方程式为_______________________;
(4)为了检验淀粉是否已经完全水解,取少量水解液于试管中,加入碘水。则证明淀粉未完全水解的现象是_____________。
【答案】作催化剂 NaOH溶液 中和作催化剂的硫酸,使检验水解产物的实验得以顺利进行;H+ +OH- ═H2O (C6H10O5)n+nH2O ![]() nC6H12O6 溶液变蓝
nC6H12O6 溶液变蓝
【解析】
(1)因淀粉水解需要催化剂,所以20%的H2SO4溶液作催化剂,故答案为:作催化剂;
(2)因淀粉水解用稀硫酸催化剂,检验葡萄糖时溶液要呈碱性,故要加氢氧化钠溶液中和硫酸,答案为:NaOH溶液;中和作催化剂的硫酸,使检验水解产物的实验得以顺利进行,离子反应为H+ +OH- ═H2O;
(3)反应①为淀粉的水解,化学方程式为:(C6H10O5)n+nH2O ![]() nC6H12O6 ;
nC6H12O6 ;
(4)因淀粉未完全水解时还有淀粉分子存在,而碘能使淀粉变蓝,故答案为:溶液变蓝。

 阅读快车系列答案
阅读快车系列答案【题目】有科学家正在研究用碳与一氧化氮反应处理环境问题
C(s)+2NO(g)![]() CO2(g)+N2(g)△H
CO2(g)+N2(g)△H
(1)实验方案中有下列措施:①采用加热提高反应速率,②使用催化剂提高反应速率,③使用加压提高NO转化率,④使CO2转化成干冰从体系用脱离,提高NO的转化率,你认为可行的是_________。
(2)这个反应的平衡常数表达式是_________________;
(3)在恒容恒温密闭容器中,科学家得到下列实验数据
时间(min) | 浓度(mol/L) | ||
NO | N2 | CO2 | |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
反应在该温度下的平衡常数K=_________________;
(4)若在(3)的实验中30min时开始升温,36min时达平衡,测得NO的转化率变为50%,则该反应的△H_______0(填“>”、“<”、“=”),判断的理由是___________________;
(5)若科学家在30min后改变了某一条件,反应进行到40min时达平衡浓度分别为c(NO)=0.032mol/L,c(N2)=0.034mol/L,c(CO2)=0.017mol/L,则改变的条件可能是______,判断的依据是____________________。