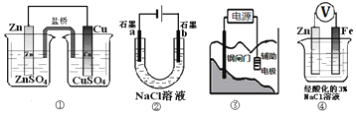
题目内容
【题目】在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=
(2)计算此反应在800C时的化学平衡常数k=
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正) V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:![]() H=-393.5kJ/mol
H=-393.5kJ/mol
![]() H=-566kJ/mol
H=-566kJ/mol
![]() H=-571.6kJ/mol
H=-571.6kJ/mol
则C(s)+H2O(g)![]() CO(g)+H2(g) H= 。
CO(g)+H2(g) H= 。
【答案】
(1)0.005mol/(L.min);
(2)0.429 ;
(3)<;
(4)+175.3kJ/mol
【解析】
试题分析:(1)前2min内,反应的氧化铜为0.04mol,则反应的CO为0.02mol,v(CO)= = 0.005mol/(L.min),故答案为:0.005mol/(L.min);
= 0.005mol/(L.min),故答案为:0.005mol/(L.min);
(2)平衡时,反应的氧化铜为0.06mol,则反应的CO为0.03mol,生成的CO2为0.03mol,在800C时的化学平衡常数k=![]() =
=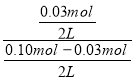 =0.429,故答案为:0.429;
=0.429,故答案为:0.429;
(3)若向平衡后的体系中加入CO和CO2各0.05mol,此时Qc=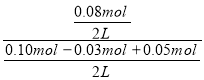 =0.667>K,平衡逆向移动,V(正)<V(逆),故答案为:<;
=0.667>K,平衡逆向移动,V(正)<V(逆),故答案为:<;
(4)已知:①![]() H=-393.5kJ/mol,②
H=-393.5kJ/mol,②![]() H=-566kJ/mol,③
H=-566kJ/mol,③![]() H=-571.6kJ/mol,根据盖斯定律,将①- (②+③),得:C(s)+H2O(g)
H=-571.6kJ/mol,根据盖斯定律,将①- (②+③),得:C(s)+H2O(g)![]() CO(g)+H2(g) H=(-393.5kJ/mol)-
CO(g)+H2(g) H=(-393.5kJ/mol)-![]() [(-566kJ/mol)+( -571.6kJ/mol)]= +175.3kJ/mol,故答案为:+175.3kJ/mol。
[(-566kJ/mol)+( -571.6kJ/mol)]= +175.3kJ/mol,故答案为:+175.3kJ/mol。

【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol/L)如图所示。

(1)当pH=3时,溶液中铜元素的主要存在形式是__________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH值为______ (填序号)。
A.<1 B.4左右 C.8>PH>6 D.>9
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是_____________________________________________。
(4)已知一些难溶电解质的溶度积常数如右下表:
物质 | FeS | MnS | PbS | HgS | ZnS | CuS |
Ksp | 6.3×10-18 | 2.5×10-13 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 | 1.3×10-35 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的___________(填序号)。
A.NaOH B.FeS C.Na2S D.NH4Cl