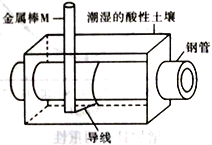
题目内容
【题目】关于下列装置说法正确的是( )
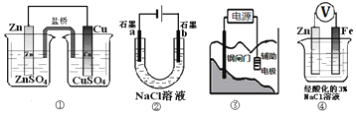
A. 装置①中,盐桥中的Cl-移向CuSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH降低
C. 装置③中钢闸门应与外接电源的正极相连获得保护
D. 装置④中电子由Zn经导线流向Fe,Zn极发生氧化反应
【答案】D
【解析】原电池中,阴离子向负极移动。锌比铜活泼,锌为负极,所以盐桥中的Cl-移向ZnSO4溶液,选项A错误。装置②a电极是电解氯化钠溶液的阴极,其反应为2H+ + 2e- = H2↑,水电离的氢离子转化为氢气,剩余了水电离的氢氧根离子,所以溶液的pH升高,选项B错误。保护金属时,应该将金属连接在电源的负极上,以保证金属不会失电子被氧化,选项C错误。装置④中Zn比Fe活泼所以Zn为负极,电子由Zn经导线流向Fe,Zn极发生失电子的氧化反应,选项D正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=
(2)计算此反应在800C时的化学平衡常数k=
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正) V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:![]() H=-393.5kJ/mol
H=-393.5kJ/mol
![]() H=-566kJ/mol
H=-566kJ/mol
![]() H=-571.6kJ/mol
H=-571.6kJ/mol
则C(s)+H2O(g)![]() CO(g)+H2(g) H= 。
CO(g)+H2(g) H= 。