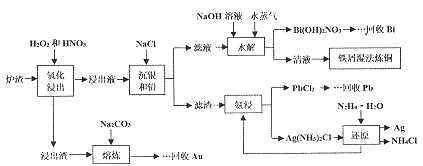
题目内容
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10L0.1mol·L-1氨水与10L0.1mol·L-1盐酸混合:[Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1mol·L-1NH4Cl溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
D. 10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
【答案】B
【解析】A. NH3·H2O+HCl![]() NH4Cl+H2O,恰好完全反应形成氯化铵溶液,NH4+水解使溶液呈酸性,[Cl-]>[NH4+]>[H+]>[OH-],故A错误;B. NH4Cl+NaOH
NH4Cl+H2O,恰好完全反应形成氯化铵溶液,NH4+水解使溶液呈酸性,[Cl-]>[NH4+]>[H+]>[OH-],故A错误;B. NH4Cl+NaOH![]() NaCl+NH3·H2O,恰好完全反应形成一水合氨和氯化钠的混合溶液,NH3·H2O
NaCl+NH3·H2O,恰好完全反应形成一水合氨和氯化钠的混合溶液,NH3·H2O![]()
![]() +
+ ![]() -,所以[Na+]=[Cl-]>[OH-]>[H+],故B正确;C. CH3COOH+NaOH
-,所以[Na+]=[Cl-]>[OH-]>[H+],故B正确;C. CH3COOH+NaOH![]() CH3COONa+H2O,恰好完全反应形成CH3COONa溶液,CH3COONa水解使溶液呈碱性,所以[Na+]>[CH3COO-]>[OH-]>[H+],故C错误;D. CH3COONa+HCl
CH3COONa+H2O,恰好完全反应形成CH3COONa溶液,CH3COONa水解使溶液呈碱性,所以[Na+]>[CH3COO-]>[OH-]>[H+],故C错误;D. CH3COONa+HCl![]() CH3COOH+NaCl,恰好完全反应形成醋酸和氯化钠的混合溶液,CH3COOH
CH3COOH+NaCl,恰好完全反应形成醋酸和氯化钠的混合溶液,CH3COOH![]() CH3COO-+H+,所以[Cl-]=[Na+]>[H+]>[OH-],故D错误。故选B。
CH3COO-+H+,所以[Cl-]=[Na+]>[H+]>[OH-],故D错误。故选B。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=
(2)计算此反应在800C时的化学平衡常数k=
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正) V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:![]() H=-393.5kJ/mol
H=-393.5kJ/mol
![]() H=-566kJ/mol
H=-566kJ/mol
![]() H=-571.6kJ/mol
H=-571.6kJ/mol
则C(s)+H2O(g)![]() CO(g)+H2(g) H= 。
CO(g)+H2(g) H= 。