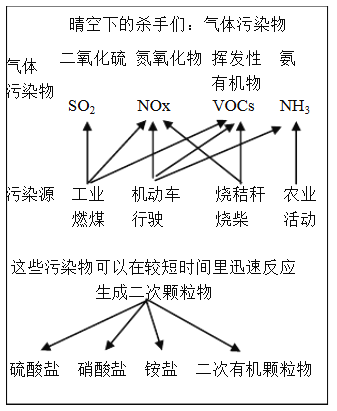
题目内容
【题目】下表是元素周期表的一部分,针对表中的①⑩种元素,填写下列空白(涉及具体元素对应化学符号表示):

(1)在这些元素中,化学性质最不活泼的是_______(填元素符号)元素⑩在周期表中的位置______。形成化合物最多的元素______(填序号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是:______。
(3)用电子式表示元素④与⑥的化合物的形成过程:_________________.
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是________。
(5)元素③的氢化物的结构式为_____;该氢化物在一定条件下可以生成另一种③的氢化物和③的单质。
【答案】 Ar 第四周期第ⅦA族 ① HClO4 ![]()
![]() S2->Cl->O2- H—O—O—H
S2->Cl->O2- H—O—O—H
【解析】由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br。
(1)稀有气体的Ar的最外层为稳定结构,化学性质最不活泼;⑩为Br,名称为溴,位于周期表中第四周期VIIA族,形成化合物最多的元素碳元素;正确答案:Ar;第四周期VIIA族;①。
(2)上述元素中最高价含氧酸中HClO4的酸性最强;K的金属性最强,故KOH的碱性最强,其电子式为![]() ;正确答案:HClO4;
;正确答案:HClO4;![]() 。
。
(3)元素④与⑥的化合物为Na2S,由钠离子与硫离子构成,属于离子化合物,用电子式表示形成为:![]() ;正确答案:
;正确答案:![]() 。
。
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->Cl->O2-;正确答案:S2->Cl->O2-。
(5)过氧化氢在一定条件下分解为水和氧气,因此过氧化氢的结构式为H—O—O—H;正确答案:H—O—O—H。

 名校课堂系列答案
名校课堂系列答案【题目】常温下时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5 | K1=4.3×10﹣7 | 3.0×10﹣8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为 .
(2)同浓度的CH3COO﹣、HCO ![]() 、CO
、CO ![]() 、ClO﹣结合H+的能力由强到弱的顺序为 .
、ClO﹣结合H+的能力由强到弱的顺序为 .
(3)同浓度的醋酸钠、次氯酸钠、碳酸钠三种溶液的pH值由小到大的顺序为 .