题目内容
(14分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)Z的原子结构示意图为 ; Z在周期表中的位置是
_______________;B元素的名称为______________。
(2)化合物Y2X2的电子式为 ;它含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_______________________________________。
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为_____________________________________。
(5)1980年我国首次制成一辆燃氢汽车,乘员12人,以50 km/h行驶了40 km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较低经济的制氢方法是__________(填写编号)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后,还需要解决的问题是___________________。(写出其中的一个)
6(14分)
(1)原子结构示意图(略);第三周期ⅥA族;碳 (各1分)
(2)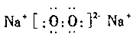 (2分)
A、C(2分)
(2分)
A、C(2分)
(3)H2O2+H2S=S↓+2H2O(2分)
(4)氧气;(1分) H2 – 2e- + 2OH- == 2H2O(2分)
(5)③ 氢气的液化、氢气的安全储存等(其它合理答案都得分)(各1分)
【解析】





