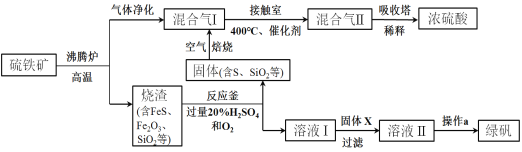
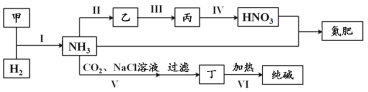
题目内容
【题目】熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- =34CO2+10H2O。
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
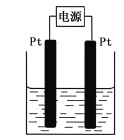
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水
①写出反应的离子方程式 。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若电解后得到200mL 3.25mol/LNaOH溶液,则消耗C4H10 的体积在标准状况下为 mL。
【答案】(1)2C4H10+13O2=8CO2+10H2O;
(2)O2+2CO2 +4e-=2CO32-
(3)CO2;负极反应产物
(4)①2Cl-+2H2O![]() Cl2↑+H2↑+2OH- ;②5Cl2+I2+6H2O=10HCl+2HIO3;③560
Cl2↑+H2↑+2OH- ;②5Cl2+I2+6H2O=10HCl+2HIO3;③560
【解析】
试题分析:(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,故答案为:2C4H10+13O2=8CO2+10H2O;
(2)燃料电池中负极上是燃料失电子的氧化反应子,电极反应式为:2C4H10+26CO32--52e-=34CO2+10H2O;故答案为:2C4H10+26CO32--52e-=34CO2+10H2O;
(3)由于原电池的负极产物有水生成,所以负极必有CO32-参加反应,同时根据碳守恒可知必需通入CO2,二氧化碳可以来自负极反应产物,故答案为:CO2;负极反应产物;
(4))①电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为:2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
②氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,故答案为:5Cl2+I2+6H2O═2HIO3+10HCl;
③氢氧化钠的物质的量=3.25mol/L×0.2L=0.65mol,根据2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-知,生成0.65mol氢氧化钠时转移电子的物质的量=
Cl2↑+H2↑+2OH-知,生成0.65mol氢氧化钠时转移电子的物质的量=![]() ×2=0.65mol,串联电池中转移电子数相等,所以丁烷的体积=
×2=0.65mol,串联电池中转移电子数相等,所以丁烷的体积=![]() ×22.4L/mol=560mL,故答案为:560。
×22.4L/mol=560mL,故答案为:560。