题目内容
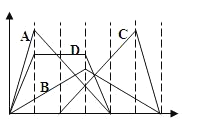
【题目】甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H =-90.8 kJ·mol-1。在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1。在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
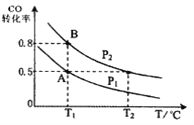
(1)T1℃反应的平衡常数为_______________。
(2)图中P1 _______ P2(填“>”、“<”或“=”)。
(3)如反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积V(B)=__________L。
(4)关于反应CO(g)+2H2(g)![]() CH3OH(g)在化学平衡状态B时的描述正确的是___
CH3OH(g)在化学平衡状态B时的描述正确的是___
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2v正(CH3OH)= v正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(5)已知CO2(g)+H2(g) ![]() CO(g) + H2O(g) △H = + 41.3 kJ·mol-1 ,试写出由CO2和H2制取甲醇的热化学方程式___________________________________。
CO(g) + H2O(g) △H = + 41.3 kJ·mol-1 ,试写出由CO2和H2制取甲醇的热化学方程式___________________________________。
(6)以CH3OH、O2、稀H2SO4组成燃料电池,写出该电池正极的电极反应式:__。
【答案】4L2/mol2 < 4 AD CO2(g)+3H2(g) ![]() CH3OH ( g ) + H2O(g) △H = - 49.5kJ·mol-1 O2+4H++4e- = 2H2O
CH3OH ( g ) + H2O(g) △H = - 49.5kJ·mol-1 O2+4H++4e- = 2H2O
【解析】
(1)本题考查化学平衡常数,CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g )
CH3OH ( g )
起始: 10 20 0
变化: 5 10 5
平衡: 5 10 5 根据化学平衡常数表达式K= 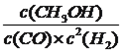 =
= 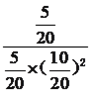 =4;(2)考查勒夏特列原理,反应前气体系数之和大于反应后气体系数之和,增大压强,平衡向正反应方向移动,即CO转化率增大,因此P2>P1;(3)考查化学平衡常数的应用,CO ( g ) + 2H2 ( g )
=4;(2)考查勒夏特列原理,反应前气体系数之和大于反应后气体系数之和,增大压强,平衡向正反应方向移动,即CO转化率增大,因此P2>P1;(3)考查化学平衡常数的应用,CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g )
CH3OH ( g )
起始: 10 20 0
变化: 8 16 8
平衡: 2 4 8 K= 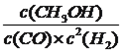 =
=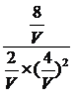 =4,解得V=4L;(4)本题化学平衡状态的判断,A、根据化学平衡状态的定义,组分不再改变,说明反应达到平衡,即达到平衡,CO的含量保持不变,故A正确;B、因为不清楚通入量,因此达到平衡时CH3COH浓度和CO浓度不一定相等,故B错误;C、用不同物质的化学反应速率表示达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,v正(CH3OH)说明反应向正反应方向进行,v正(H2)说明反应向正反应方向进行,不符合上述分析,故C错误;D、根据M=m/n,组分都是气体,气体质量不变,反应前后气体系数之和不相等,因此M不变说明反应达到平衡,故D正确;(5)考查热化学反应方程式的计算,①CO ( g ) + 2H2 ( g )
=4,解得V=4L;(4)本题化学平衡状态的判断,A、根据化学平衡状态的定义,组分不再改变,说明反应达到平衡,即达到平衡,CO的含量保持不变,故A正确;B、因为不清楚通入量,因此达到平衡时CH3COH浓度和CO浓度不一定相等,故B错误;C、用不同物质的化学反应速率表示达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,v正(CH3OH)说明反应向正反应方向进行,v正(H2)说明反应向正反应方向进行,不符合上述分析,故C错误;D、根据M=m/n,组分都是气体,气体质量不变,反应前后气体系数之和不相等,因此M不变说明反应达到平衡,故D正确;(5)考查热化学反应方程式的计算,①CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H =-90.8 kJ·mol-1,②CO2(g)+H2(g)
CH3OH ( g ) △H =-90.8 kJ·mol-1,②CO2(g)+H2(g) ![]() CO(g) + H2O(g) △H = + 41.3 kJ·mol-1 ,CO2+3H2=CH3OH+H2O,①+②得出CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.5kJ·mol-1;(6)考查电池电极反应式的书写,根据原电池的工作原理,氧气在正极上得电子,因为环境是酸性,因此正极反应式为: O2+4H++4e- = 2H2O。
CO(g) + H2O(g) △H = + 41.3 kJ·mol-1 ,CO2+3H2=CH3OH+H2O,①+②得出CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.5kJ·mol-1;(6)考查电池电极反应式的书写,根据原电池的工作原理,氧气在正极上得电子,因为环境是酸性,因此正极反应式为: O2+4H++4e- = 2H2O。

【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是__________________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________________。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有_______________________________________。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因________。
(4)步骤Ⅲ中,加入Na2SO3的目的是_______________________。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:______
![]()
②下面检测钝化效果的方法合理的是______。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
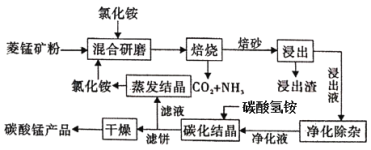
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
回答下列问题:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
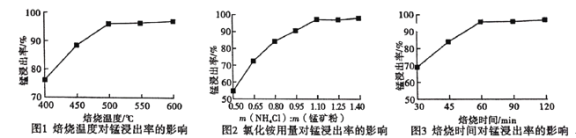
焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为____。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时, c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为_____________________________________________。
(5)流程中能循环利用的固态物质是____________。