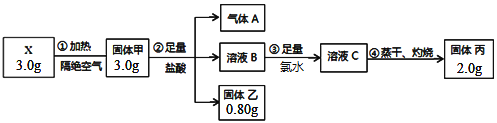
题目内容
【题目】如图是元素周期表的一部分。

(1)②、⑥、⑧的离子半径由大到小的顺序为____________(用离子符号表示)。
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_____ (用化学式表示)。
(3)As的原子结构示意图为_________其氢化物的化学式为__________;
(4)Y由②、⑥、⑧三种元索组成,它的水溶液是生活中常见的消毒剂。As 可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为__________,当消耗l mol还原剂时,电子转移了_____mol。
【答案】Cl->O2->Na+ HClO4>H3PO4>H2CO3 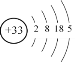 AsH3 5NaClO+2As+3H2O=2H3AsO4+5NaCl 5
AsH3 5NaClO+2As+3H2O=2H3AsO4+5NaCl 5
【解析】
(1)离子半径比较;
(2)非金属性的比较,元素非金属性越强,最高价含氧酸的酸性越强;
(1)②⑥⑧代表的元素分别为Na、O、Cl。它们的离子分别为Na+、O2-、Cl-。Cl-有3个电子层,而Na+和O2-电子层只要2个,则Cl-的半径最大。Na+和O2-的核外电子排布相同,核电荷数越大,半径越小,则Na+半径小于O2-,由大到小的顺序为Cl->O2->Na+;
(2)④⑦⑧代表的元素分别为C、P、Cl,它们最高价含氧酸分别为H2CO3、H3PO4、HClO4。非金属性越强,其最高价氧化物的水化物的酸性越强,则HClO4的酸性比H3PO4的酸性强,H2CO3的酸性比H3PO4的酸性弱,排序为HClO4>H3PO4>H2CO3;
(3)As为33号元素,其各层电子数分别为2、8、18、5,其原子结构示意图为 。其与N同主族,氢化物与NH3类似,氢化物为AsH3;
。其与N同主族,氢化物与NH3类似,氢化物为AsH3;
(4)②⑥⑧分别是Na、O、Cl,Y的水溶液为常见的消毒剂,为NaClO。As可与NaClO反应得到H3AsO4,As的化合价升高,从0升高到+5,,则Cl的化合价降低,从+1到-1。化合价升降守恒,则As和NaClO的比例为2:5,根据原子守恒可以配平,方程式为5NaClO+2As+3H2O=2H3AsO4+5NaCl。还原剂为As,其化合价从0升高到+5,则消耗1molAs,电子转移5mol。

 阅读快车系列答案
阅读快车系列答案【题目】下表数据是对应物质的熔点:
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
熔点℃ | 920 | 801 | 1291 | 160 | -107 | 2072 | -57 | 1723 |
(1)上述涉及原子中最活泼非金属原子核外电子排布式是________________;某阴离子的轨道表示式为![]() ,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
,其核外电子占有的轨道总数是_____个,有______种能量不同的电子,有_____种不同运动状态的电子。
(2)物质①的电子式:____________,⑦的结构式:_______________。
(3)④溶于水溶液呈酸性,用离子方程式表示其原因_______________________________;若把其溶液加热蒸干并灼烧,得到的固体是_______________。
(4)不能用于比较Na与Al金属性相对强弱的事实是_________________。
A.最高价氧化物对应水化物的碱性 B.Na最外层1个电子而Al 最外层3个电子
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(5)⑧比⑦熔点高出很多,其理由是:_____________________________;①和②都属于离子晶体,但①比②的熔点高,请解释原因____________________________。