题目内容
【题目】为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、Hg、U”等元素的代言人。回答下列问题:
(1)N在周期表中的位置是__。
(2)下列有关性质的比较,能用元素周期律解释的是__。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(3)非金属性:Cl>Br,用原子结构解释原因__,用一个离子方程式证明__。
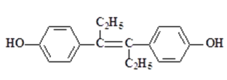
(4)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。
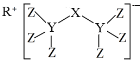
①Y的元素符号为__。②X的氢化物的电子式__。
【答案】第二周期第ⅤA族 bc 氯与溴最外层电子数相同,氯比溴少一层,原子半径比溴小,得电子能力比溴强,非金属性Cl>Br Cl2+2Br-=Br2+2Cl- Si ![]()
【解析】
(1)N的核电荷数是7,其原子结构示意图为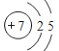 ;
;
(2)结合同周期、同主族元素的性质递变规律分析;
(3)单质之间的置换反应可说明非金属性强弱;
(4)R、X、Y、Z为同一短周期元素,根据图知,Y能形成4个共价键、Z能形成1个共价键,则Y位于第IVA族、Z位于第VIIA族,且Z核外最外层电子数是Y核外电子数的一半,Z最外层7个电子,则Y原子核外有14个电子,故Y为Si元素,Z为Cl元素;该阴离子中Cl元素为-1价、Si元素为+4价,根据化合价的代数和为-1价可知,X为-3价,则X为P元素;根据阳离子所带电荷知,R为Na元素,据此解答。
(1)N原子结构示意图为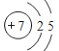 ,则N在周期表中的位置是第二周期第ⅤA族;
,则N在周期表中的位置是第二周期第ⅤA族;
(2)a.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:Cl>S,则酸性:HClO4>H2SO4,而HCl的酸性大于HCl>H2SO3无法用元素周期律解释,故a错误;
b.同主族元素从上到下非金属性依次减弱,则非金属性:C>S,能用元素周期律解释,故b正确;
c.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,故c正确;
d.酸式碳酸盐易分解,碳酸盐难分解,则热稳定性:Na2CO3>NaHCO3,不能用元素周期律解释,故d错误;
(3)氯与溴最外层电子数相同,氯比溴少一层,原子半径比溴小,得电子能力比溴强,非金属性Cl>Br,根据氧化剂的氧化性大于氧化产物,则Cl2+2Br-=Br2+2Cl-可证明非金属性:Cl>Br;
(4)通过以上分析知:R、X、Y、Z分别为Na、P、Si、Cl元素;
①由分析知:Y的元素符号为Si;
②X为P元素,其氢化物的分子式为PH3,是共价化合物,则其电子式为![]() 。
。

【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是______,属于金属材料的是______(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是______。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为______,反应基本类型是______。
【题目】水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发):
时间 | ① | ② | ③ | ④ | ⑤ |
温度/℃ | 20 | 30 | 40 | 从40℃冷却到20℃ | 沸水浴后冷却到20℃ |
颜色变化 | 红色略加深 | 红色接近① | 红色比③加深较多 | ||
pH | 8.31 | 8.29 | 8.26 | 8.31 | 9.20 |
下列说法不正确的是( )
A.NaHCO3溶液显碱性的原因:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B.①→③的过程中,颜色加深的原因可能是HCO3-水解程度增大
C.①→③的过程中,pH略微下降说明升温过程中c(OH-)减小
D.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故
【题目】I.CO、CO2的应用和治理是当今社会的热点问题。
CO工业上可用于高炉炼铁,发生如下反应: 1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是____(选填序号)
a.及时吸收或移出CO2 b.增大反应体系的压强
c.用更高效的催化剂 d.粉碎矿石,增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
II.合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)+Q(Q>0)。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。
一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.2υ正(NH3)=υ逆(H2O) b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101 kPa d.24000 kPa