题目内容
【题目】下图中,甲、乙、丙、丁分别代表相应物质与水发生的化学反应。回答下列问题:
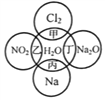
(1)甲、乙、丙、丁中,不属于氧化还原反应的是______________(用甲乙丙丁填空,下同),属于置换反应的是____________。
(2)写出丁反应中产物的化学式:______________,写出甲反应的化学方程式:________________________________。
【答案】 丁 丙 NaOH Cl2+H2O=HCl+HClO
【解析】(1)甲、乙、丙、丁分别与水反应的方程式为:Cl2+H2O=H++Cl-+HClO、3NO2+H2O=2HNO3+NO、2Na+2H2O=2Na++2OH-+H2↑、Na2O+H2O=2Na++2OH-,因此甲、乙、丙、丁中不属于氧化还原反应的是氧化钠与水,属于置换反应的是钠与水。(2)根据以上分析可知丁反应中产物的化学式为NaOH,甲反应的化学方程式为Cl2+H2O=HCl+HClO。

【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题。
(1)N原子核外有___种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
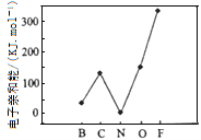
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______________________;氮元素的E1呈现异常的原因是_______________________。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___________________。
(4)铵盐大多不稳定。NH4F、NH4I中,较易分解的是____,原因是__________________。
(5)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(6)已知:①NO2 + CO ![]() CO2 + NO
CO2 + NO
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】实验室需用450 mL3.0 mol·L-1 H2SO4溶液,某同学用98%的浓硫酸 (密度为1.84 g/mL)按下列步骤来配制。
(1)请回答有关问题。
实验步骤 | 有关问题 |
a.计算所需浓H2SO4的体积; | 量取浓H2SO4的体积为①__________ |
b.量取浓硫酸; | |
c.将浓H2SO4慢慢加入到装有蒸馏水的200 mL烧杯中; | |
d.将烧杯中的溶液冷却后转移至②__________中; | |
e.洗涤后,向容量瓶中加蒸馏水距刻度线1~2cm,改用③__________定容。 |
(2)配制H2SO4溶液时,若出现下列操作,其结果偏高还是偏低?
A.量取浓H2SO4溶液时仰视读数 ____;
B.定容时仰视刻度线 ___;
C.浓硫酸溶于水后未经冷却就转移____。








