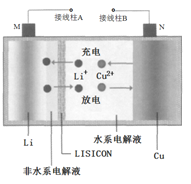
题目内容
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题。
(1)N原子核外有___种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
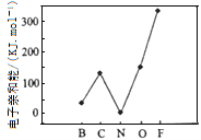
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______________________;氮元素的E1呈现异常的原因是_______________________。
(3)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___________________。
(4)铵盐大多不稳定。NH4F、NH4I中,较易分解的是____,原因是__________________。
(5)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(6)已知:①NO2 + CO ![]() CO2 + NO
CO2 + NO
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式_________________。
【答案】 七(或“7”) 哑铃形(或纺锤形) 根据图(a),同周期随着核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 氮元素的2p能级达到半满状态,原子相对稳定,不易失去电子 sp、sp2 NH4F F原子半径比I原子小,H→F键比H→I键强(H→F更易形成),F-更易夺取NH4+中的H+ Be、C、O ![]()
![]()
【解析】(1). N是7号元素,核外有7种不同运动状态的电子,N原子的核外电子排布式为1s22s22p3,在基态N原子中,能量最高的电子所占据的原子轨道是2p,形状为哑铃形(或纺锤形),故答案为:七(或“7”);哑铃形(或纺锤形);
(2). 根据图(a)可知,同周期元素随着核电荷数依次增大,原子半径逐渐变小,吸引电子的能力逐渐增强,故结合一个电子释放出的能量依次增大,故答案为:根据图(a),同周期随着核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;
(3). 经测定发现,N2O5固体由NO2+和NO3-两种离子组成,NO2+的价层电子对数为:2+![]() =2,NO3-的价层电子对数为:3+
=2,NO3-的价层电子对数为:3+![]() =3,所以该固体中N原子杂化类型为sp、sp2,故答案为:sp、sp2;
=3,所以该固体中N原子杂化类型为sp、sp2,故答案为:sp、sp2;
(4). F和I属于同一主族元素,因F原子半径比I原子小,非金属性F>I,所以H→F键比H→I键更强,H→F键比H→I键更易形成,F-更易夺取NH4+中的H+,所以NH4F、NH4I中,较易分解的是NH4F,故答案为:NH4F;F原子半径比I原子小,H→F键比H→I键强(H→F更易形成),F-更易夺取NH4+中的H+;
(5). 同一周期中,随原子序数的增大,元素的第一电离能呈增大趋势,Be是4号元素,核外电子排布式为1s22s2,是一种全充满的稳定结构,所以第一电离能Be>B,N原子的核外电子排布式为:1s22s22p3,是一种半充满的稳定结构,所以第一电离能N>O,则第二周期中,第一电离能介于B元素和N元素间的元素为Be、C、O,故答案为:Be、C、O;
(6). 由表中数据可知,反应NO2(g) + CO(g)![]() CO2(g) + NO(g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol= -234kJ/mol,已知:①NO2(g) + CO(g)
CO2(g) + NO(g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol= -234kJ/mol,已知:①NO2(g) + CO(g)![]() CO2(g) + NO(g)的ΔH=-234kJ/mol、② N2(g)+O2(g)
CO2(g) + NO(g)的ΔH=-234kJ/mol、② N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol、③ 2NO(g) +O2(g)
2NO(g) ΔH=+179.5 kJ/mol、③ 2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol,根据盖斯定律可知,①×2+③-②得:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol。
2NO2(g) ΔH=-112.3 kJ/mol,根据盖斯定律可知,①×2+③-②得:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol。

【题目】请根据所学知识回答下列问题:
酸 | 电离常数 |
CH3COOH | K = 1.8×10 -5 |
H2CO3 | K1= 4.3×10 -7,K2= 5.6×10 -11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
(1)NaHSO3溶液中共存在7种微粒,它们是Na+、HSO3-、H+、SO32-、H2O、________、_________(填微粒符号)。
(2)常温下,物质的量浓度相同的下列溶液 :
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④ NH4HSO4
溶液中c(NH4+)最大的是:_________,最小的是:______(填序号)
(3)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为___________(填序号)
(4)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):_____________把AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是________(填化学式)