题目内容
下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白.
(1)在这些元素中化学性质最不活泼的是
(2)①②⑥⑦中原子半径最小的是
(3)表中氧化性最强的单质的化学式为
(4)这些元素的最高价氧化物的水化物中,碱性最强的是
(5)⑥⑦两种元素中,离子半径较小的是
(6)④⑧⑨三种元素的气态氢化物的稳定性强弱顺序为
(7)①与③形成的化合物中,固态时俗称干冰的结构式
(8)画出⑨的原子结构示意图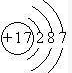
 .
.
(9)元素②的氢化物与元素⑨的氢化物反应的化学方程式为
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
Ne
Ne
(填元素符号)(2)①②⑥⑦中原子半径最小的是
N
N
(填元素符号);(3)表中氧化性最强的单质的化学式为
F2
F2
;(4)这些元素的最高价氧化物的水化物中,碱性最强的是
NaOH
NaOH
(填化学式);(5)⑥⑦两种元素中,离子半径较小的是
Al3+
Al3+
(填离子符号);(6)④⑧⑨三种元素的气态氢化物的稳定性强弱顺序为
HF
HF
>HCl
HCl
>H2S
H2S
(填化学式);(7)①与③形成的化合物中,固态时俗称干冰的结构式
O=C=O
O=C=O
,该化合物属于共价
共价
(填“共价”或“离子”)化合物.(8)画出⑨的原子结构示意图


(9)元素②的氢化物与元素⑨的氢化物反应的化学方程式为
NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
;该反应的产物属于离子
离子
(填“共价”或“离子”)化合物.分析:根据元素在周期表在的位置可知,①为C,②为N,③为O,④为F,⑤为Ne,⑥为Na,⑦为Al,⑧为S,⑨为Cl;
(1)最外层电子数为8的原子,化学性质不活泼;
(2)电子层越少,半径越小,在同一周期,从左到右,半径在减小;
(3)非金属性越强,对应单质的氧化性强;
(4)金属性越强,对应最高价氧化物的水化物的碱性越强;
(5)具有相同电子排布的离子,离子半径的比较规律为:径小序大;
(6)非金属性越强,气态氢化物的稳定性越强;
(7)通过共用电子对形成的化合物为共价化合物,将共用电子对用短横来表示的式子为结构式;
(8)利用原子序数来分析电子层数和最外层电子数;
(9)氨气与氯化氢在常温下反应生成氯化铵,氯化铵中含有离子键.
(1)最外层电子数为8的原子,化学性质不活泼;
(2)电子层越少,半径越小,在同一周期,从左到右,半径在减小;
(3)非金属性越强,对应单质的氧化性强;
(4)金属性越强,对应最高价氧化物的水化物的碱性越强;
(5)具有相同电子排布的离子,离子半径的比较规律为:径小序大;
(6)非金属性越强,气态氢化物的稳定性越强;
(7)通过共用电子对形成的化合物为共价化合物,将共用电子对用短横来表示的式子为结构式;
(8)利用原子序数来分析电子层数和最外层电子数;
(9)氨气与氯化氢在常温下反应生成氯化铵,氯化铵中含有离子键.
解答:解:根据元素在周期表在的位置可知,①为C,②为N,③为O,④为F,⑤为Ne,⑥为Na,⑦为Al,⑧为S,⑨为Cl;
(1)上述元素中只有Ne的最外层电子数为8,其化学性质最不活泼,故答案为:Ne;
(2)①②⑥⑦中①②有2个电子层,半径比⑥⑦的小,由同一周期,从左到右,半径在减小,则②的半径最小,②为N,故答案为:N;
(3)给出的元素中只有F的非金属性越强,则对应单质F2的氧化性强,故答案为:F2;
(4)给出的元素中只有Na金属性越强,对应最高价氧化物的水化物NaOH的碱性越强,故答案为:NaOH;
(5)⑥⑦两种元素的离子具有相同电子排布的离子,Al的原子序数大,则Al3+的离子半径小,故答案为:Al3+;
(6)④⑧⑨三种元素的非金属性为F>Cl>S,则气态氢化物的稳定性为HF>HCl>H2S,故答案为:HF;HCl;H2S;
(7)①与③形成的化合物为CO2,其电子式为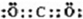 ,则结构式为O=C=O,通过共用电子对形成的化合物为共价化合物,故答案为:O=C=O;共价;
,则结构式为O=C=O,通过共用电子对形成的化合物为共价化合物,故答案为:O=C=O;共价;
(8)⑨为Cl,有3个电子层,最外层电子数为7,则原子结构示意图为 ,故答案为:
,故答案为: ;
;
(9)氨气与氯化氢在常温下反应生成氯化铵,其反应为NH3+HCl═NH4Cl,氯化铵中含有离子键,则氯化铵为离子化合物,故答案为:NH3+HCl═NH4Cl;离子.
(1)上述元素中只有Ne的最外层电子数为8,其化学性质最不活泼,故答案为:Ne;
(2)①②⑥⑦中①②有2个电子层,半径比⑥⑦的小,由同一周期,从左到右,半径在减小,则②的半径最小,②为N,故答案为:N;
(3)给出的元素中只有F的非金属性越强,则对应单质F2的氧化性强,故答案为:F2;
(4)给出的元素中只有Na金属性越强,对应最高价氧化物的水化物NaOH的碱性越强,故答案为:NaOH;
(5)⑥⑦两种元素的离子具有相同电子排布的离子,Al的原子序数大,则Al3+的离子半径小,故答案为:Al3+;
(6)④⑧⑨三种元素的非金属性为F>Cl>S,则气态氢化物的稳定性为HF>HCl>H2S,故答案为:HF;HCl;H2S;
(7)①与③形成的化合物为CO2,其电子式为
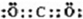 ,则结构式为O=C=O,通过共用电子对形成的化合物为共价化合物,故答案为:O=C=O;共价;
,则结构式为O=C=O,通过共用电子对形成的化合物为共价化合物,故答案为:O=C=O;共价;(8)⑨为Cl,有3个电子层,最外层电子数为7,则原子结构示意图为
 ,故答案为:
,故答案为: ;
;(9)氨气与氯化氢在常温下反应生成氯化铵,其反应为NH3+HCl═NH4Cl,氯化铵中含有离子键,则氯化铵为离子化合物,故答案为:NH3+HCl═NH4Cl;离子.
点评:本题考查位置、结构、性质的关系,明确元素在周期表中的位置是解答本题的关键,然后利用元素及其化合物的性质来解答即可,难度不大,但本题考查点较多,应注意归纳方法来解答此类习题.

练习册系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是