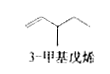
题目内容
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体, 溶液的pH(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度(填“增 大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和2H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 , 平衡常数表达式为;若有1mol硝酸铵完全分解,转移的电子数为mol。
(3)由N2O、H2O反应生成N2和NO2的能量变化如图所示,若生成1molN2 , 其△H= kJ/mol。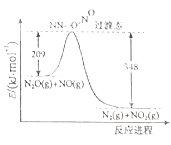
【答案】NH3·H2O![]() NH4++OH-;降低;增大;NH4NO3
NH4++OH-;降低;增大;NH4NO3![]() N2O+2H2O;c(N2O)c2(H2O);4;-139
N2O+2H2O;c(N2O)c2(H2O);4;-139
【解析】(1)氨学中的一水合氨部分电离产生铵根离子和氢氧根离子,使溶液显碱性;若加入氯化铵,则铵根离子浓度增大,一水合氨的电离平衡逆向移动,氢氧根离子浓度减小,pH降低;若加入少量的明矾,铝离子水解重复性,抑制铵离子水解,溶液中的![]() 的浓度增大;
的浓度增大;
(2)根据题意可书写反应的化学方程式,注意为可逆反应;根据平衡常数的定义可书该反应的平衡常数表达式,硝酸铵为固体,不能表示平衡常数;硝酸铵中N元素的化合价从+5价降低到-1价或从-3价升高到+1价,1够专移4个电子,所以生成lmo氮气则转移4mol电子;
(3)根据图像可知![]() 与NO反应生成氮气和二氧化氮的反应热为
与NO反应生成氮气和二氧化氮的反应热为![]() 。
。
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案