��Ŀ����
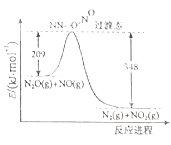
����Ŀ����1����������A, ���Է�������ͼ��ʾ��Ӧ������E��IΪ��ѧ��������ǿ�ᣬ��
![]()
��AΪ_____________��
��F![]() G�Ļ�ѧ����ʽΪ______________________��
G�Ļ�ѧ����ʽΪ______________________��
��Fe������I��ϡ��Һ��Ӧ�����ӷ���ʽ______________________________________��
����CO2�����л�������C������ȥCʱ�����ѡ��_______�Լ���
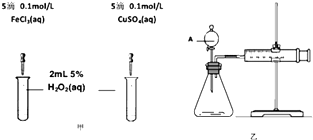
��2��Ǧ���仯������������ء������豸��X���߷������ϵȡ��ش��������⣺
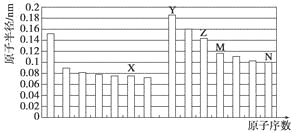
�� Ǧ��̼��ͬ��Ԫ�أ���̼��4�����Ӳ㡣Ǧ��Ԫ�����ڱ���λ��Ϊ��_____���ڣ���____�壻
�� PbO2��Ũ���Ṳ�����ɻ���ɫ���壬��Ӧ�Ļ�ѧ����ʽΪ________________��
�� PbO2����PbO�����������Һ��Ӧ�Ƶã���Ӧ�����ӷ���ʽΪ______________��
�� PbO2�ڼ��ȹ��̷����ֽ��ʧ��������ͼ��ʾ����֪ʧ�������ϵ�a��Ϊ��Ʒʧ��4.0% (��![]() ���IJ������塣��a�������ɱ�ʾΪPbOx��mPbO2��nPbO������x��ֵ��m ��n��ֵx=_______��m ��n=________��
���IJ������塣��a�������ɱ�ʾΪPbOx��mPbO2��nPbO������x��ֵ��m ��n��ֵx=_______��m ��n=________��

���𰸡� (NH4)2S ![]() Fe+4H++NO3��=Fe3++NO��+2H2O ����NaHCO3 �� ��A PbO2+4HCl(Ũ)
Fe+4H++NO3��=Fe3++NO��+2H2O ����NaHCO3 �� ��A PbO2+4HCl(Ũ) ![]() PbCl2+Cl2��+2H2O PbO+ClO��=PbO2+Cl�� 1.4 2:3
PbCl2+Cl2��+2H2O PbO+ClO��=PbO2+Cl�� 1.4 2:3
��������(1). �ٳ�������������ˮ��Ӧ���ɵ�ǿ��Ϊ��������ᣬ��A�ֱ�����ͼӦ����S2-��NH3��AΪ(NH4)2S����F![]() GΪ��������������NO��ˮ������ʽΪ
GΪ��������������NO��ˮ������ʽΪ![]() ����ϡ�������ǿ�����ԣ�����ϡ���ᷴӦ����+3�������ӣ����ӷ���ʽΪ��Fe+4H++NO3��=Fe3++NO��+2H2O���ܶ�����̼�����ڱ���̼�����ƣ�SO2����֮��Ӧ�������Լ�ӦΪ����̼�����ƣ�
����ϡ�������ǿ�����ԣ�����ϡ���ᷴӦ����+3�������ӣ����ӷ���ʽΪ��Fe+4H++NO3��=Fe3++NO��+2H2O���ܶ�����̼�����ڱ���̼�����ƣ�SO2����֮��Ӧ�������Լ�ӦΪ����̼�����ƣ�
(2). ��Ǧ��̼ͬ���壬λ�ڵ������ڣ���A���壻�ڻ���ɫ����ΪCl2��Cl-��������Pb��+4�۱���ԭ������ʽΪ��PbO2+4HCl(Ũ) ![]() PbCl2+Cl2��+2H2O����PbO�����������Һ��Ӧ��Pb��+2�۱�������ClԪ�ر���ԭ������PbO2��Cl-�����ӷ���ʽΪ��PbO+ClO��=PbO2+Cl������PbO2�ڼ��ȹ��̷�����Ӧ�Ļ�ѧ����ʽΪPbO2
PbCl2+Cl2��+2H2O����PbO�����������Һ��Ӧ��Pb��+2�۱�������ClԪ�ر���ԭ������PbO2��Cl-�����ӷ���ʽΪ��PbO+ClO��=PbO2+Cl������PbO2�ڼ��ȹ��̷�����Ӧ�Ļ�ѧ����ʽΪPbO2![]() PbOx+
PbOx+ ![]() (2-x)O2�������跴Ӧ��PbO2Ϊ1mol������Ϊ239g����
(2-x)O2�������跴Ӧ��PbO2Ϊ1mol������Ϊ239g���� ![]() (2-x)��32=239��4.0%��x=1.4����ÿ1mol PbOx�к�1.4mol��ԭ�ӣ����ݻ�������ΪmPbO2 nPbO����(2m+n)=1.4�� (m+n) =1�����m=0.4��n=0.6����m:n=2/3��
(2-x)��32=239��4.0%��x=1.4����ÿ1mol PbOx�к�1.4mol��ԭ�ӣ����ݻ�������ΪmPbO2 nPbO����(2m+n)=1.4�� (m+n) =1�����m=0.4��n=0.6����m:n=2/3��

 ��У����ϵ�д�
��У����ϵ�д�